共有結合の例
化学 / / July 04, 2021
ザ・ 共有結合 は 2つの原子は電子を共有することによって結合します、オクテットのルールを完成させます。
共有結合の歴史
化学者が分子がどのようにそしてなぜ形成されたかを理解し始めたのは20世紀初頭でした。 最初の大きな進歩は、 ギルバート・ルイス 何について 化学結合の形成 ことを意味します 原子は電子を共有します. ルイスは、水素の化学結合の形成を次のように説明しました。
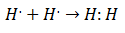
このタイプの電子対は、共有結合の例です。 2つの電子は2つの原子によって共有されます. ザ・ 共有化合物 彼らはそれです 共有結合のみを含む.
共有結合の電子
簡単にするために、 共有電子対 多くの場合、 単線 要素のシンボルを接続します。 したがって、水素分子の共有結合はH-Hと表記されます。
共有結合では、共有ペアの各電子 両方の原子の原子核に引き付けられます. この引力は、H分子の2つの原子を一緒に保持します。2 そしてそれは他の分子の共有結合の形成に責任があります。
いくつかの電子の原子間の共有結合で 価電子のみが参加します、最も浅い軌道で最も外側にあります。 そのうちの1人から3人が組合に参加します。
結合に関与しない他の電子は、 非結合性電子、またはペアで整理する場合は、 無料ペア. つまり、バレンシア電子のペアは 共有結合形成に参加しない.
共有結合の表現
Hなどの共有化合物が表される構造2 およびF2 として知られています ルイス構造式. ルイス構造式は 共有結合の表現、共有電子のペア 線または2つの原子間の点のペアとして示されます、および共有されていないフリーペアは、個々の原子上の点のペアとして示されます。 ルイス構造式では、価電子のみが表示され、内部電子は表示されません。
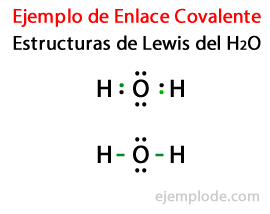
水分子Hのルイス構造式を考える2または、水素原子と酸素原子のすべての価電子が最初にドットでマークされます。
2番目のケースでは、リンクは線でマークされています。 そして、酸素にのみ存在するフリーペアとポイント。
オクテット則
水Hの分子のようなこれらの分子の形成2または、呼び出しを説明します オクテット則、ルイスによって提案された:水素以外の原子は、それ自体を囲むまで結合を形成する傾向があります 8つの価電子つまり、個々の原子がオクテットを完成させるのに十分な電子がない場合、共有結合が形成されます。
共有結合で電子を共有することにより、 各原子はそのオクテットを完了します. 水素の場合、要件は、合計2つの電子を持つヘリウムの電子配置を取得することです。
オクテット則は主に機能します 周期表の2番目の周期または行の要素の場合. これらの要素には、合計8つの電子が存在する可能性のあるサブレベルがあります。
これらの元素の原子が共有化合物を形成すると、ネオン希ガスの電子配置が得られ、同じ化合物内の他の原子と電子が共有されます。
共有結合の種類
原子はさまざまな種類の共有結合を形成できます。 シングル、ダブルまたはトリプル.
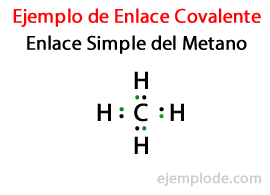
で シンプルリンク、2つの原子はによって結合されます 電子対. それらは共有化合物の大部分で発生し、それはこの結合の最も基本的な形です。
多くの化合物では、 ダブルリンク、つまり、2つの原子が共有する場合 2対の電子. 2つの原子が2対の電子を共有する場合、共有結合は二重結合と呼ばれます。 これらの結合は、二酸化炭素(CO)などの分子に見られます。2)およびエチレン(C2H4).

A トリプルリンク 2つの原子が共有するときに発生します 3対の電子、窒素N分子のように2、アセチレンC分子2H2.

複数の結合は単一の共有結合よりも短いです。 ザ・ リンクの長さ として定義されます 2つの結合した原子の核間の距離 分子内の共有結合によって。
共有結合性化合物とイオン性化合物の違い
イオン性化合物と共有結合性化合物は、結合の性質が異なるため、一般的な物理的特性に著しい違いがあります。
の中に 共有化合物 存在する 2種類の引力; それらの1つは 分子の原子を一緒に保持するもの. この魅力の定量的尺度は 結合エネルギー. 他の引力は完全な分子間で作用し、 分子間力. 分子間力は通常、分子の原子をまとめる力よりも弱いため、共有化合物の分子はより少ない力で結合します。
続けて、 共有結合化合物は、ほとんどの場合、低融点の気体、液体、または固体です。n。 一方、イオンをまとめる静電力 イオン性化合物では、それらは通常非常に強いです、イオン性化合物が室温で固体であり、高融点を有するように。 多くのイオン性化合物は水溶性であり、これらの化合物は強電解質であるため、それらの水溶液は電気を通します。
ほとんど 共有結合性化合物は水に不溶性です、そしてそれらが溶解した場合、 その水溶液 いつものように 彼らは電気を通しません これらの化合物は非電解質であるためです。 溶融イオン性化合物は、自由に動く陽イオンと陰イオンを含んでいるため、電気を通します。 溶融または液体の共有結合化合物は、イオンが存在しないため、電気を通しません。
共有結合した化合物の例
- アセチレンC2H2
- メタンCH4
- エタンC2H6
- プロパンC3H8
- ブタンC4H10
- ベンゼンC6H6
- トルエンC7H8
- メチルアルコールCH3ああ
- エチルアルコールC2H5ああ
- プロピルアルコールC3H7ああ
- メチルエーテルCH3OCH3
- メチルエチルエーテルC2H5OCH3
- エチルエーテルC2H5OC2H5
- ギ酸HCOOH
- 酢酸CH3COOH
- プロピオン酸C2H5COOH
- 酪酸C3H7COOH
- 一酸化炭素CO2
- 一酸化炭素CO
- 分子状窒素N2
- 水素分子H2
