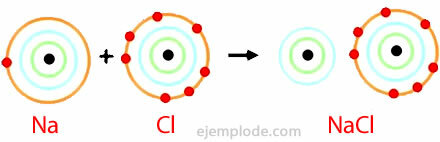
イオン結合の例
化学 / / July 04, 2021
イオン結合は、陽イオンと陰イオン、反対の符号の電荷を持つ化学種の存在によって与えられます。 これは、イオン性化合物のイオンを結合する静電力として定義されます。
イオン化エネルギーの低い元素の原子は、陽イオンを形成する傾向があります。 対照的に、電子親和力が高いものは陰イオンを形成する傾向があります。
アルカリおよびアルカリ土類金属はイオン性化合物で陽イオンを形成する可能性が高く、ハロゲンと酸素は陰イオンを形成する可能性が最も高いです。 結果として、多種多様なイオン性化合物の組成は、IA族またはIIA族の金属とハロゲンまたは酸素の組み合わせから生じます。
たとえば、フッ化リチウムとフッ素の反応により、フッ化リチウムが生成されます。フッ化リチウムは、はんだの融点を下げるため、およびセラミックの製造に使用される有毒な白色粉末です。 リチウムの電子配置は1秒です2、2秒1、フッ素のそれは1秒です2、2秒2、2 P5. これらの原子が接触すると、価電子2s1 リチウムはフッ素原子に移動します。
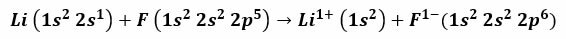
手順はリチウム電子の脱離から始まり、これをイオン化して正の1+原子価に達すると想定するのが妥当です。 フッ素がこの電子を受け取り続けると、負の電荷が発生します。 結局、イオン結合の形成は静電引力によって起こります。 フッ化リチウム化合物は電気的に中性になります。
多くの一般的な反応は、イオン結合の形成につながります。 たとえば、酸素中のカルシウムの燃焼は酸化カルシウムを生成します:
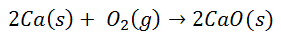
二原子酸素分子は2つの個別の原子に分離します。 次に、カルシウム原子から各酸素原子への2つの電子の移動があります。 両方にそれぞれの電荷があります。各原子のカルシウム2+、および各原子の酸素2-です。 最終的な結合時に、酸化カルシウム分子は電気的に中性です。
イオン性化合物の格子エネルギー
元素のイオン化エネルギーと電子親和力の値を使用して、何を予測することができます 元素はイオン性化合物を形成しますが、このタイプの安定性を評価することも必要です 化合物。
イオン化エネルギーと電子親和力は、気相で発生するプロセスに対して定義されていますが、すべてのイオン性化合物は1気圧および25°Cで固体です。 各陽イオンが特定の数の陰イオンに囲まれているため、固体状態は非常に異なる状態です。逆もまた同様です。 したがって、固体イオン性化合物の全体的な安定性は、陽イオンと陰イオンの相互作用だけでなく、すべてのイオンの相互作用に依存します。
イオン性固体の安定性の定量的尺度は、 格子エネルギー、これは次のように定義されます 固体イオン性化合物のモルを気体状態のイオンに完全に分離するために必要なエネルギー。
格子エネルギーを決定するためのボルンハーバーサイクル
格子エネルギーを直接測定することはできません。 ただし、イオン性化合物の構造と組成がわかっている場合は、クーロンの法則を適用してその格子エネルギーを計算することができます。 は、2つのイオン間の位置エネルギーは、それらの電荷の積に正比例し、それらの間の距離に反比例すると述べています。 止まる。
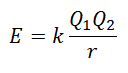
陽イオンの電荷は正であり、陰イオンの電荷は負であるため、この製品はエネルギーに負の結果をもたらします。 これは発熱反応を表しています。 したがって、プロセスを逆にするには、エネルギーを供給する必要があります。
イオン性化合物がいくつかの段階で形成されると仮定すると、格子エネルギーを間接的に決定することも可能です。 この手順は、 ボルンハーバーサイクル、これは、イオン性化合物の格子エネルギーを、イオン化エネルギー、電子親和力、およびその他の原子および分子特性と関連付けます。 この方法は、ヘスの化学反応の代数和の法則に基づいており、MaxBornとFritzHaberによって開発されました。 ボルンハーバーサイクルは、イオン性固体の形成に先行するさまざまな段階を定義します。

塩化ナトリウム
塩化ナトリウムは、融点が801°Cのイオン性化合物で、溶融状態および水溶液中で電気を伝導します。 岩塩は塩化ナトリウムの供給源の1つであり、多くの場合数百メートルの厚さの地下堆積物に含まれています。 塩化ナトリウムは、海水または塩水(濃縮NaCl溶液)からも太陽熱蒸発によって得られます。 また、それは岩塩と呼ばれる鉱物に自然界に見られます。

塩化ナトリウムは、無機化合物の製造において他のどの材料よりも多く使用されています。 この物質の世界の消費量は年間約1億5000万トンです。 塩化ナトリウムは、主に塩素ガス、水酸化ナトリウム、金属ナトリウム、水素ガス、炭酸ナトリウムなどの他の無機化合物の製造に使用されます。 また、高速道路や道路の氷や雪を溶かすためにも使用されます。