ボイルの法則の例
物理 / / July 04, 2021
ガスの性質を研究するとき、 ロバートボイル、 一方では、そして エドム・マリオット一方、彼らは実験を知らずに、または知らずに、ガスが圧縮される可能性があり、それらの体積がそれらがさらされる圧力に比例して変化することを観察しました。
彼の研究を理解するには、このガスの研究で考慮すべき3つの特性、温度、体積、圧力があることに留意する必要があります。
温度:実験条件下でガスが検出される温度です。 摂氏(°C)またはケルビンまたは絶対零度(°K)で表すことができます。 ボイルの法則の場合、温度は変化しない、つまり一定であると見なされます。
体積:密閉容器内でガスが占める空間です。 最初の意図では、ガスの体積は容器の体積です。 その表現のために、容器は閉じられており、注射器などのプランジャーを備えていると見なされます。
圧力:ガスがプランジャーを通過する圧力です。 プランジャーが蓋として置かれている密閉容器内では、圧力をかけずに、大気圧(1 at)であると見なされます。
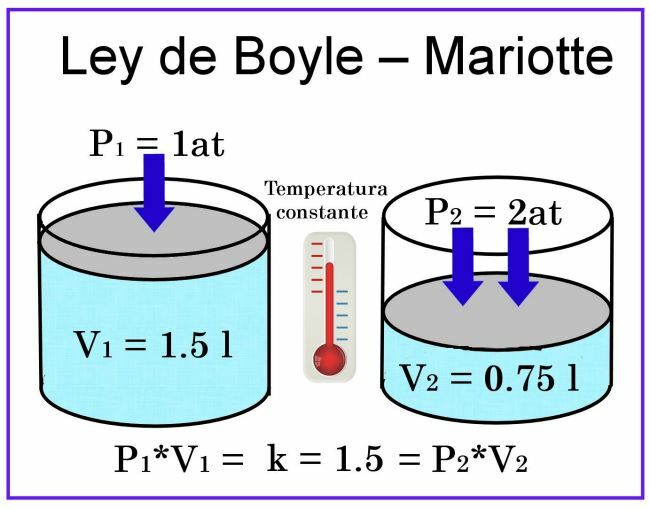
ボイルとマリオットの観測では、温度は一定であると見なされているため、測定に影響はありません。
容量については、例えば容量1リットルの円筒形の容器を考えれば、その蓋はプランジャーです スライドさせて、空気で満たされた容器を覆うように置くと、圧力は1 atになり、体積は1になります。 リットル。 プランジャーに2気圧の圧力がかかると、ガスの量は半分、つまり0.5リットルまたは500mlに減少します。 圧力が4気圧に上昇すると、容量は4分の1、つまり0.25リットルまたは250mlに減少します。
これらの観察に基づいて、呼び出しが発表されました ボイルの法則:一定の温度では、ガスの体積はそれにかかる圧力に反比例します。
これは、圧力が増加すると体積が減少し、圧力が減少すると体積が増加することを意味します。
これは、ガスの圧力とその体積の間に関係があることを確立することにつながります。 コンポーネントの1つ、もう1つは同じ比率で変化し、関係は一定のままです。 いう:
P * V = k
P =圧力
V =ボリューム
k =圧力と体積の関係の定数
これを理解するために、空気で満たされた2.5リットルのコンテナがあり、キャッププランジャーの圧力が1.5atであるとします。 したがって、あなたの関係の定数は次のとおりです。
P * V = k =(2.5)(1.5)= 3.75
ここで圧力を3気圧に上げると、kを圧力Pで割ると、次のようになります。
k / P = V
3.75 / 3 = 1.25リットル
ご覧のとおり、2倍の圧力を加えると、体積は元の半分になり、圧力と体積の関係の定数が維持されます。 これは次のように表されます。
V1P1 = V2P2 = k
つまり、体積1と圧力1の積は、体積2と圧力2の積に等しく、この関係は一定のままです。
ボイルの例-マリオットの法則
例1. 3.5 atの圧力が適用された場合、2atの圧力で3.75リットルの体積を占めるガスが占める体積を計算します。
V1 = 3.75 l
P1 = 2で
V2 = ?
P2 = 3.5 at
Vとして1P1 = V2P2 = k
システムの定数を計算します。
V1P1= k =(3.75)(2)= 7.5
Vを解きます2:
V2 = k / P2 = 7.5 / 3.5 = 2,143リットル
例2. ガスが2.25リットルの体積を占めている場合、1.75の圧力で、3.25リットルの体積を持っている場合、ガスに加えられる圧力を計算します。
V1 = 3.25 l
P1 = 1.75 at
V2 = 2.25 l
P2 = ?
システムの定数を計算します。
V1P1= k =(3.25)(1.75)= 5.6875
Pを解きます2:
P2 = k / V2 = 5.6875 / 2.25 = 2.53 at
例3. ガスの元の圧力を計算します。4.5atの圧力を加えたときに、ガスが1.4リットルの体積を占め、元の体積が2.2リットルだった場合。
V1 = 2.2 l
P1 = ?
V2 = 1.4 l
P2 = 4.5 at
システムの定数を計算します。
V2P2= k =(1.4)(4.5)= 6.3
Pを解きます2:
P1 = k / V1 = 6.3 / 2.2 = 2.863 at



