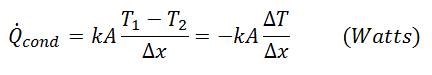AUFBAU原理の例
物理 / / July 04, 2021
ザ・ aufbauの原理 (構成)は原子物理学の原理であり、 原子核の周りの軌道における電子の配置を説明します.
原子の性質や形状を理解するためのさまざまな研究が、多くの研究者の研究対象となっています。 その中で注目すべきは、アーネスト・ラザフォードによって提案された原子モデルを完成させたデンマークの物理学者、ニールス・ボーアの作品です。
彼のモデルには次の特徴があります。原子の核が中心を占め、電子が円軌道で回転します。 円軌道でエネルギーを失わない理由を説明し、波動の発見と 電子が持っているのと同じ粒子時間、彼は電子がエネルギー準位から別のエネルギー準位にジャンプし、放出または吸収すると考えました エネルギー。

これらの軌道レベルが方程式2nによって支配されていることをご存知ですか2言い換えれば、軌道上の電子の最大数は、軌道の数の2乗の2倍に等しい。 これまでに知られている元素については、7つの既知の軌道があり、K軌道には2つの電子、L、8つの電子があります。 Mには18個の電子があり、Nには32個、Oには50個、Pには72個、Qには98個の電子が含まれています。
電子には4つの量子数があることも発見されました。主nは、原子核からの距離を示します。 磁気量子数mが位置する軌道(s、p、d、fなど)を示す方位角量子数l。 軌道内の軌道と、正または負のスピン数sを決定します。 1/2. 同じ経路にある2つの電子(同じ数nとl)は、同じ磁気量子数または同じスピン数を同時に持つことはできません。 つまり、原子内の2つの電子が4つの等しい量子数すべてを持つことはできません(パウリの排他原理)
これは、異なる電子が同じ軌道レベルで共存するために、レベルが エネルギー学はサブレベルに分割され、各サブレベルは1対の軌道のみを含むことができる軌道に分割されます。 電子。
この観察によれば、エネルギー準位Kには、sレベルと呼ばれる1つのサブレベルしか含まれていません。このサブレベルは、1つまたは2つの電子によって占有されます。
次のレベルLには、4つの電子サブレベルがあります。2sと呼ばれるレベルsと、2pと呼ばれる3つの軌道で構成される2pと呼ばれるレベルです。バツ、2 PY および2pz. 3番目のレベルには、3s、3p、および3dのサブレベルがあります。 3dサブレベルには5つの軌道があり、それぞれが2つの電子によって占められます。 次のレベルには、f、g、h、iの文字で追加される軌道を含めることができます。
これに加えて、電子がエネルギー準位を完了するのに十分でない場合、それらは軌道に分布します。 (フントの法則)。
これらのサブレベルと軌道はランダムに埋められません。 軌道上の電子は、最初に低いエネルギーレベルを満たし、次に高いエネルギーレベルを埋めることによって編成されます。 これはグラフィカルに表され、そのため、のこぎりまたは対角線のルールと呼ばれます。
前の規則によれば、周期表の最初の10個の元素の軌道レベルは次のように表されます。
H:1秒1
彼:1秒2
Li:1秒2 、2秒1
Be:1秒2 、2秒2
B:1秒2 、2秒2、2 P1 (1秒2 、2秒2、[2 Pバツ1)
C:1秒2 、2秒2、2 P2 (1秒2 、2秒2、[2 Pバツ1、2 PY1])
N:1秒2 、2秒2、2 P3 (1秒2 、2秒2、[2 Pバツ1、2 PY1、2 Pz1])
O:1秒2 、2秒2、2 P4 (1秒2 、2秒2、[2 Pバツ2、2 PY1、2 Pz1])
F:1秒2 、2秒2、2 P5 (1秒2 、2秒2、[2 Pバツ2、2 PY2、2 Pz1])
Ne:1秒2 、2秒2、2 P6 (1秒2 、2秒2、[2 Pバツ2、2 PY2、2 Pz2])
これらの例に見られるように、最初にエネルギーの少ないレベルが満たされます。この場合はsレベルであり、次にpレベルです。
また、レベルの飽和が不活性ガスのヘリウムとネオンで発生することも確認できます。
多くの周期表では、データの一部としてエネルギー準位の電子構造が見つかります。 簡単に言うと、括弧内に要素の前の不活性要素があり、次に残りのレベルがあります。 軌道。
たとえば、ナトリウムの場合、次の2つの方法のいずれかで表されていることがわかります。
Na:1秒2 、2秒2、2 P6、3秒1
Na:[Ne]、3秒1
ここで、サブレベルのグラフを見ると、たとえば、カリウムや カルシウムは、レベル4であるにもかかわらず、エネルギーがより高いため、3Dサブレベルを占有しません。 レベル4秒。 したがって、ボーアの法則によれば、レベル4が最初に占有され、3dの前になります。
K:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒1 -[Ar]、4秒1
Ca:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2 -[Ar]、4秒2
Sc:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒1、3D1 -[Ar]、4秒1、3D1
Ti:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D2 -[Ar]、4秒2、3D2
構造原理による軌道の順序と、グラフの対角線を観察することで推測できる順序は、次のようになります。
1秒2、2秒2、2 P6、3秒2、3p6、4秒2、3D10、4p6、5秒2、4d10、5 p6、6秒2、4f14、5 d10、6p6、7秒2
構造原理の例
構造原理に従ったいくつかの要素の電子レベルの表現:
はい:1秒2 、2秒2、2 P6、3秒2、3p2 -[Ne]、3秒2、3p2
P:1秒2 、2秒2、2 P6、3秒2、3p4 -[Ne]、3秒2、3p4
Ar:P:1秒2 、2秒2、2 P6、3秒2、3p6 -[Ne]、3秒2、3p6
V:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D3 -[Ar]、4秒2、3D3
信仰:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D6 -[Ar]、4秒2、3D6
Zn:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10 -[Ar]、4秒2、3D10
Ga:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p1 -[Ar]、4秒2、3D10、4p1
Ge:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p2 -[Ar]、4秒2、3D10、4p2
Br:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p5 -[Ar]、4秒2、3D10、4p5
Kr:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6 -[Ar]、4秒2、3D10、4p6
Rb:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒1 -[Kr]、5秒1
シニア:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2 -[Kr]、5秒2
Y:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d1 -[Kr]、5秒2、4d1
Zr:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d2 -[Kr]、5秒2、4d2
Ag:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d9 -[Kr]、5秒2、4d9
Cd:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d10 -[Kr]、5秒2、4d10
I:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d9、5 p5 -[Kr]、5秒2、4d9、5 p5
Xe:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d10、5 p6 -[Kr]、5秒2、4d10、5 p6
Cs:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d9、5 p6、6秒1 -[Xe]、6秒1
Ba:1秒2 、2秒2、2 P6、3秒2 、3p6、4秒2、3D10、4p6、5秒2、4d10、5 p6、6秒2 -[Xe]、6秒2