ალკენების 20 მაგალითი
Miscellanea / / July 04, 2021
ალკენები Ისინი არიან ნაერთები ნახშირბად-ნახშირბადის ორმაგი ბმების შემცველი. როდესაც ამ ნაერთებს აქვთ ღია ჯაჭვის სტრუქტურა, ისინი რეაგირებენ C მოლეკულურ ფორმულაზენჰ2n (სად ნ ნახშირბადის ატომების რაოდენობაა). ალკენებს ოლეფინებს უწოდებენ და შეესაბამება ჯგუფის ჯგუფს ნახშირწყალბადები გაჯერებული ისინი მიიღება ძირითადად, როგორც ნავთობის გატეხვის პროცესის ნაწილი და ალკანების დეჰიდროგენიზაცია. Მაგალითად: ეთენი, პროპენი, ციკლოჰექსენი.
ისინი ორგანული ნაერთებია, რომლებიც შეიძლება იყოს მოკლე, საშუალო ან გრძელი ჯაჭვი; ასევე არსებობს ციკლური ალკენები ან ციკლოალკენები. ნახშირბად-ნახშირბადის ორმაგი ბმის არსებობით, ალკენებს ნაკლები წყალბადები აქვთ ალკანები შესაბამისი თანაბარი რაოდენობით ატომები ნახშირბადის.
როგორ ასახელებენ ალკენებს?
ალკენების დასახელებისათვის, ნახშირბადის ჯაჭვი რომელიც შეიცავს ნახშირბადის ატომების უდიდეს რაოდენობას და ასევე შეიცავს ორმაგ ბმას. თუ ამ ჯაჭვს აქვს რამდენიმე ორმაგი ბმა, ისინი დასახელდნენ ამ ორმაგი ობლიგაციების პოზიციების მაქსიმალურად მცირე კომბინაციის მოსაძებნად.
პოზიცია ორმაგი ბმა
ეს მითითებულია სუფიქსის წინ - არა ლათინური პრეფიქსით, რომელიც მიუთითებს ნახშირბადის რაოდენობას, სადაც იწყება ორმაგი კავშირი (di (2), tri (3), tetra (4), penta (5), octa (8) და ა.შ.). შემცვლელი ნივთიერებები (ჩვეულებრივ ქლორის, ბრომის, ეთილის, მეთილის და ა.შ.) დასახელებულია როგორც პრეფიქსი (სახელის დასაწყისში), დაწვრილებითი და ანბანური თანმიმდევრობით, მათ ასევე ასახელებენ მათი პოზიციების ყველაზე მცირე კომბინაციის ძიებაში ჯაჭვი. Მაგალითად: 1-ბუტენი / 1,2-ბუტადიენი / 5-ქლორო-1-პენტენი / 4-პენტენილ ქლორიდი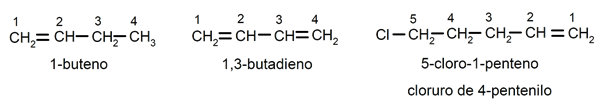
იმის გათვალისწინებით, თუ რამდენად რთულია ქიმიური სახელი დადგენილი შესაბამისად IUPAC კრიტერიუმებიბუნებაში არსებულ ბევრ ორგანულ ალკენს აქვს ლამაზი სახელები, რომლებიც ხშირად დაკავშირებულია მათ ბუნებრივ წყაროსთან. Მაგალითად: ლიმონენი / 1-მეთილ-4- (1-მეთილეთენილ) -ციკლოჰექსენი / გერანიოლი / 3,7-დიმეთილ-2,6-ოქტადიენ-1-ოლი
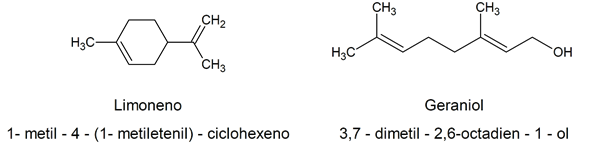
ალკონები ოთხამდე ნახშირბადშია გაზები ოთახის ტემპერატურაზე, ვისაც აქვს 4-დან 18 ნახშირბადი Ისინი არიან სითხეები და ყველაზე გრძელი არიან მყარი. ისინი ხსნიან გამხსნელები ორგანული, როგორიცაა ეთერი ან ალკოჰოლი და ოდნავ უფრო მკვრივია ვიდრე შესაბამისი ალკანები (ეს არის იგივე რაოდენობის ნახშირბადის ატომები).
წერტილი შერწყმა ი დუღილი ალკენების, ისევე როგორც ალკანებში, იზრდება ნახშირბადის ჯაჭვი.
მეორეს მხრივ, იმის გამო ორმაგი ბმით წარმოქმნილი ძაბვა, ალკენის ორმაგ ბმაში ჩართული ნახშირბადის ატომებს შორის მანძილია 1,34 შუადღისას (პიკომეტრები), ხოლო ერთი ბმის მანძილი შესაბამის ალკანში არის 1.54 გვ.
ისინი წარმოადგენენ ა ქიმიური რეაქტიულობა ალკანზე ბევრად უფრო მაღალია, ზუსტად იმიტომ, რომ მათ აქვთ ორმაგი ბმა, რომელსაც სიმკვრივე აქვთ ელექტრონიკა, რომელიც მაღალია და შეიძლება დაიშალოს და დაუშვას სხვა ატომების, ხშირად წყალბადის ან ჰალოგენები. მათ ასევე შეუძლიათ განიცადონ დაჟანგვა და პოლიმერიზაცია.
ალკენები ჩვეულებრივ წარმოადგენენ cis-trans იზომერია ან სტერეოიზომერია, ვინაიდან ორმაგი ბმით დაკავშირებული ნახშირბადის ატომები ვერ ბრუნავს და ეს იწვევს შემცვლელების განლაგებას ორმაგი კავშირის იმავე მხარეს ან მოპირდაპირე მხარეებზე. Მაგალითად: ტრანს-2-ბუტენი / ცის-2-ბუტინი
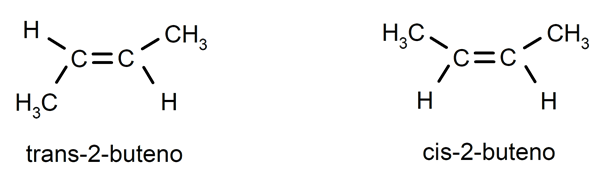
ალკენებს, რომლებსაც აქვთ ორი ორმაგი ბმა, დიენებს უწოდებენ, ხოლო მათ, ვისაც ორზე მეტი ორმაგი ბმა აქვთ, პოლიენებს უწოდებენ.
მცენარეულ სამყაროში, ალკენები საკმაოდ უხვი და აქვთ ფიზიოლოგიური როლები ძალიან მნიშვნელოვანია, როგორიცაა ხილის სიმწიფის პროცესის რეგულირება ან სხვა ფილტრაცია გარკვეული მზის გამოსხივების.
ორგანული ალკენების ქიმიური სტრუქტურა, როგორც წესი, საკმაოდ რთულია და მოიცავს ნახშირბადის ჯაჭვებს და რგოლებს. ზოგიერთი ხილი (მაგალითად სტაფილო ან პომიდორი) და ზოგი კიბოსნაირნი (როგორც კიბორჩხალები) წარმოქმნის მნიშვნელოვან რაოდენობას ბეტა კაროტინს, მნიშვნელოვან ალკენს, რომელიც A ვიტამინის წინამორბედია.
ალკენების მაგალითები
- ეთენი
- 2-მეთილპროპენი
- პროპენი
- 2,3-ბუტადიენი
- მირცენები
- ლიმონი
- გერანიოლი
- ლიკოპენი
- ლანოსტეროლი
- მენთოფურანი
- ტეტრაფთორეთილენი
- 1,3,5,7-ციკლოოქტატტრაენი
- 5-ბრომო-3-მეთილ-3-ჰექსენი
- 3,5-დიეთილ-4-პროპილ-2,5-დიმეთილ-2-ჰეპტენი
- 7,7,8-ტრიმეთილ-3,5-ნონადიენი
- 3,3-დიეთილ-1,4-ჰექსადიენი
- ციკლოჰექსენი
- 1-ქლორო-2-მეთილპროპ-1-ენ
- 3-ბრომო-5-მეთილ-ციკლოპენტინი
- 1-მეთილ-ციკლოჰექსენი
ამ ალკენების ქიმიური ნაერთების დიაგრამები:


