ორგანული და არაორგანული მოლეკულების მაგალითი
Ქიმია / / November 13, 2021
ზოგადი ქიმია ეს არის მეცნიერება, რომელიც სწავლობს ყველა სახის მატერია, რომელიც არსებობს, და მათი შინაგანი ცვლილებები ამის სხვადასხვა ტიპებს შორის კონტაქტი.
Ორგანული ქიმია ეს ზოგადი ქიმიის ნაწილია, რომელიც განკუთვნილია იმ საკითხის შესასწავლად, რომლის მთავარი შემადგენელი ნაწილია ნახშირბადის ელემენტი, Მერე რა ის ცოცხალი ორგანიზმების ნაწილია.
არაორგანული ქიმია ეს არის ზოგადი ქიმიის ის ნაწილი, რომელსაც ევალება ე.წ. "მინერალური ნივთიერებები", რომელიც არის ნაწილი მე არ ვცხოვრობ გარემოში.
მოლეკულა არის კავშირი სხვადასხვა ელემენტის სხვადასხვა ატომები ქიმიკატებს ახალი ნივთიერებების შესაქმნელად, მათი განსაკუთრებული თვისებებით.
ზოგადი ქიმიის, ელემენტები არიან სუფთა ნივთიერებები რომლებიც იქმნება ერთი ტიპის ატომები. ელემენტები კლასიფიცირებულია ქიმიური ელემენტების პერიოდულ ცხრილში.
ისევე, როგორც მას ატომი ელემენტების ფუნდამენტური ერთეულია, მოლეკულა არის ნაერთების ძირითადი ერთეული, რომლებიც ნივთიერებებს აქვთ დამახასიათებელი ქიმიური ქცევა.
ნაერთები შეიძლება ჩამოყალიბდეს შედეგად ბუნებრივი ფენომენიან შეიქმნება ლაბორატორიებში
ან სამრეწველო ქარხნები, ამიტომ მოლეკულები ყველგან არის წარმოდგენილი. მოლეკულები არის მინერალებში, ხის ფოთლებში, საკვებში, მედიკამენტებში, წყალში, რომელსაც ვსვამთ, ჰაერში, რომელსაც ვსუნთქავთ და გარემოს დაბინძურებაშიც კი.ზოგადი ქიმია ძირითადად იყოფა არაორგანული ქიმია ი ქიმიურირომ ორგნაიკა, ამიტომ მოლეკულების კლასიფიკაცია ასევე შესაძლებელია არაორგანულ და ორგანულ კატეგორიებად.
არაორგანული მოლეკულები
არაორგანულ ქიმიაში მოლეკულები ძირითადად წარმოიქმნება დადებითი ვალენტობის ატომების კომბინაცია უარყოფით ვალენტობათა სხვებთან, იონურ კავშირებში. ეს კავშირები წარმოიქმნება ძირითადად ელექტრომაგნიტური ძალებით ატომებს შორის, წარმოქმნილი ვალენტური ელექტრონების არსებობით.
ამრიგად წარმოიქმნება ყველა იონური ნაერთი, როგორიცაა მარილები, ოქსიზალტები, მჟავები, ოქსიაციდები, ოქსიდები და ჰიდროქსიდები.
არაორგანული მოლეკულები, როგორც ელექტროლიტები
იონური მოლეკულების მთავარი თვისებაა ის, რომ როდესაც ისინი წყალთან კონტაქტში მოდიან2ან, ისინი გამოყოფილია მის ორ ნაწილად: პოზიტიური და უარყოფითი. ეს ორი ნაწილი, ელექტრონულად დამუხტული ატომები ან ატომების ჯგუფები, წყალში იფანტება. არაორგანულ ნივთიერებას, რომელსაც შეუძლია წყალში გამოყოფა, მას ელექტროლიტს უწოდებენ.
წყალს და დადებითად და უარყოფითად დამუხტულ ნაწილაკებს წარმოქმნილ ხსნარს უწოდებენ "ელექტროლიტური ხსნარი". ამ ტიპის ხსნარს აქვს ელექტროენერგიის გატარების უნარი, რის გამოც იგი გამოიყენება ელექტროქიმიურ უჯრედებში, მაგალითად, მანქანის ბატარეებში.
არაორგანული მჟავა და ტუტე მოლეკულები
არაორგანული მოლეკულების შემთხვევაში, როგორიცაა მჟავები, ოქსიაციდები და ჰიდროქსიდებიამავე დროს, როდესაც ისინი დაყოფენ დადებით და უარყოფით ნაწილს, ისინი ხელს უწყობენ Solution– ს თვისებას, რომელსაც უწოდებენ წყალბადის პოტენციალს, იზომება როგორც წყალბადის იონის კონცენტრაციის უარყოფითი ლოგარითმი.
წყალბადის პოტენციალი (pH) განსაზღვრავს რამდენად მჟავას ხსნარი წარმოადგენს. PH- ის სკალაზე, რომელიც 1-ის მნიშვნელობიდან მაქსიმალური მჟავიანობისთვის აღწევს 14-ს, რაც არის სრული ტუტეობა ან ფუძეობა, მჟავას ხასიათი 1-დან 6-მდეა, ხოლო ტუტე 8-დან 14-ს შორის. 7 წარმოადგენს ნეიტრალურ pH- ს; არც მჟავე და არც ფუძე. H + კონცენტრაციის უარყოფითი ლოგარითმის შედეგი გვეტყვის, სად ვართ მასშტაბში.
მჟავების მაგალითები:
მარილმჟავა: HCl: H+ + კლ-
ჰიდრობრომმჟავა: HBr: H+ + ძმ-
სულფჰიდრინის მჟავა: H2S: 2H+ + ს-2
ციანჰიდრინის მჟავა: HCN: H+ + CN-
მარილმჟავა: HI: H+ + მე-
ოქსიაციდების მაგალითები:
გოგირდის მჟავა: H2SW4: 2 სთ+ + ასე რომ4-2
ნახშირმჟავა: H2კომპანია3: 2 სთ+ + CO3-2
აზოტის მჟავა: HNO3: თ+ + არა3-
ფოსფორის მჟავა: H3PO4: 3 თ+ + PO4-3
პერქლორინის მჟავა: HClO4: თ+ + ClO4-
ჰიდროქსიდების მაგალითები:
ნატრიუმის ჰიდროქსიდი: NaOH: Na+ + ოჰ-
კალციუმის ჰიდროქსიდი: Ca (OH)2: კა+ + 2OH-
ამონიუმის ჰიდროქსიდი: NH4OH: NH4+ + ოჰ-
კალიუმის ჰიდროქსიდი: KOH: K+ + ოჰ-
მაგნიუმის ჰიდროქსიდი: მგ (OH)2: მგ+ + 2OH-
არაორგანული მოლეკულები ქიმიურ რეაქციებში
როდესაც არაორგანული მოლეკულები მონაწილეობენ ქიმიურ რეაქციაში, შეიძლება არსებობდეს ოთხი ძირითადი და მარტივი რეაქციის მექანიზმი: სინთეზი, დაშლა, მარტივი ჩანაცვლება და ორმაგი ჩანაცვლება. აი თითოეული მათგანის მაგალითი:
სინთეზი
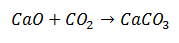
სინთეზის რეაქცია არის ის, რომელშიც ორი მოლეკულა გაერთიანდება საბოლოო პროდუქტში, რომელიც შედგება ერთი მოლეკულისგან. მაგალითად, ეს არის კალციუმის ოქსიდის კომბინაცია ნახშირბადის დიოქსიდთან და წარმოქმნის კალციუმის კარბონატის მოლეკულას.
დაშლა:

დაშლის რეაქციაა, რომელშიც საწყისი მოლეკულა გამოიყოფა ორ ახალ სტაბილურ მოლეკულად. ეს არის კალციუმის ჰიდროქსიდის შემთხვევა, რომელიც გამოიყოფა კალციუმის ოქსიდის და სხვა წყლის მოლეკულად.
მარტივი ჩანაცვლება:

ჩანაცვლების მარტივი რეაქციის დროს, ელემენტის ატომი იცვლება მოლეკულის ერთ-ერთ ატომთან. ასეთია მეტალის თუთია, რომელიც წყალბადის ქლორიდში წყალბადის ადგილას ათავსებს, ათავისუფლებს მას და ქმნის თუთიის ქლორიდის მოლეკულებს.
ორმაგი ჩანაცვლება:
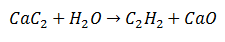
ორმაგი ჩანაცვლების რეაქციაში, იცვლება ორი საწყისი მოლეკულის გარკვეული ატომები, რომ წარმოიქმნას, როგორც პროდუქტები, ორი განსხვავებული მოლეკულა. ასეთია კალციუმის კარბიდი, რომელიც განიცდის ნახშირბადის გამოყოფას, რომელიც წყლის წყალბადთან შერწყმულია და აცეტილენს წარმოქმნის. კალციუმი შეუერთდება ჟანგბადს და წარმოქმნის კალციუმის ოქსიდს, როგორც მეორე პროდუქტს.
ორგანული მოლეკულები
ორგანული ქიმია არის ნახშირბადის ქიმია, რაც ნიშნავს, რომ ყველა ორგანულ მოლეკულას ექნება ამ ელემენტის არსებობა, სხვადასხვა სტრუქტურული წყობილებით.
ორგანული მოლეკულები ხასიათდება კოვალენტური ობლიგაციების მუდმივი არსებობა. კოვალენტური ობლიგაციები მათთან, რომელშიც ორი ატომი უერთდება ერთმანეთს, რომ გაანაწილონ თავიანთი ვალენტური ელექტრონები და ამრიგად შეავსონ თავიანთი ოქტეტები.
ეს არის ნახშირბადის შემთხვევაში, რომელიც უკავშირდება იმავე ელემენტის სხვა ატომებს. წარმოიქმნება ძალიან მრავალფეროვანი სიგრძის ჯაჭვები, ორიდან სამოცი ნახშირბადის ატომიდან და ეს ჯაჭვებიც კი ისინი ტოტებენ სხვა ჯაჭვებთან იგივე სიგრძის სიგრძით, რაც მიაღწევს მოლეკულების უზარმაზარ მრავალფეროვნებას ორგანული
ასევე არსებობს იონური ბმები, მაგრამ ეს ხდება გრძელი რეაქციის მექანიზმების შუალედურ ეტაპებზე, რომელშიც სასურველი მოლეკულა იქმნება.
ორგანული მოლეკულების უმარტივესი შეიცავს ნახშირბადს და წყალბადს. ეს უკანასკნელი ასრულებს ნახშირბადის ვალენტობას, რომელიც ამას მოითხოვს.
ორგანულ ქიმიაში მოლეკულები შეიძლება იყოს წრფივი ან ალიფატური, განშტოებული, ციკლური და არომატული.
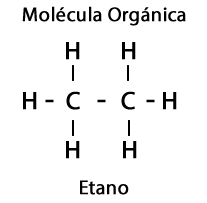
გარდა ამისა, ორგანული მოლეკულების შემადგენლობაში მონაწილეობენ ელემენტები ჟანგბადი, აზოტი, გოგირდი და ფოსფორი, რაც წარმოშობს ფუნქციური ჯგუფების შთამბეჭდავ მრავალფეროვნებას მოლეკულებისათვის.
ორგანული მოლეკულების ფუნქციური ჯგუფები
ფუნქციური ჯგუფები არის ორი ან მეტი ატომის ჯგუფი, რომლებიც ნახშირწყალბადის წყალბადის ჯაჭვის შეერთებისას ქმნიან სხვადასხვა ქიმიურ სახეობებს, განსაკუთრებული ქცევით. შემდეგი, ჩამოთვლილია ორგანული მოლეკულების შვიდი ძირითადი ტიპი, მათი შესაბამისი ფუნქციური ჯგუფებით. ნახშირბად-წყალბადის ჯაჭვის აღსანიშნავად გამოიყენება ასო "R".
ალკილ ჰალიდები - ფორმა: R-X / ფუნქციური ჯგუფი: ჰალოგენური ელემენტი (ქლორი, ბრომი, იოდი)

ალკოჰოლი - ფორმა: R-OH / ფუნქციური ჯგუფი: -OH ან ჰიდროქსილი.
ალდეჰიდები - ფორმა: R-CHO / ფუნქციური ჯგუფი: -CHO, რომელიც ყოველთვის ჯაჭვის ბოლომდე მიდის.
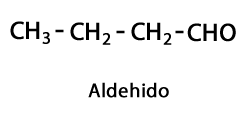
კეტონები - ფორმა: R-CO-R / ფუნქციური ჯგუფი: -CO- ან კარბოქსი, ყოველთვის ჯაჭვის ნახშირბადის შუა ნაწილში.
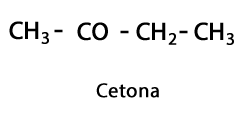
ორგანული მჟავები - ფორმა: R-COOH / ფუნქციური ჯგუფი: -COOH ან კარბოქსილი, ყოველთვის ჯაჭვის ბოლოს.
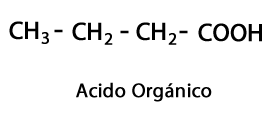
მჟავა ეთერები - ფორმა: R-COO-R / ფუნქციური ჯგუფი: -COO-, არის მჟავას ჯაჭვის სხვა ნახშირბად-წყალბადის ჯაჭვის შეერთების შედეგი.
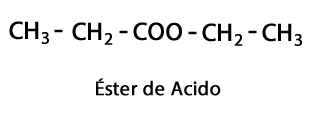
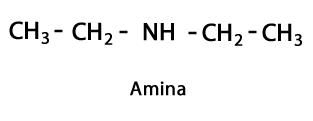
ამინები - ფორმა: R-NH2, R-NH-R, R-N-2R / ფუნქციური ჯგუფი: -NH2, -NH-, -N = ან ამინო, რომელიც არის აზოტი, რომელიც დაემატება წყალბადს იმ ადგილებში, სადაც არ არის ნახშირბადის წყალბადის ჯაჭვი. როგორც უკვე აღვნიშნეთ, მას შეუძლია ჯაჭვის ბოლოს ან შუა ნაწილში წასვლა. აზოტის ატომს შეიძლება თან ახლდეს ერთი, ორი ან სამი ორგანული ჯაჭვი, საბოლოო მოლეკულის წარმოქმნით. ამინები შეიძლება ჩაითვალოს ამიაკის NH ორგანულ წარმოებულებად3.
ორგანული მოლეკულები ქიმიურ რეაქციებში
ორგანული მოლეკულები, რაც უფრო გრძელია ნახშირბად-წყალბადის ჯაჭვები, მით უფრო მეტი ადგილია ან ატომია შესაძლებელი ქიმიურ რეაქციაში მონაწილეობის მისაღებად.
ყველაზე ხშირად, რომელიმე ნახშირბადს ემატება ელემენტები ან ჯაჭვები, ან ძირითადი ჯაჭვის ნაწილი გამოიყოფა, რომ წარმოიქმნას განსხვავებული ორგანული ნაერთი.
რადგან ასეთი რეაქციები ნელია, გამოიყენება კატალიზატორები, რომლებიც წარმოადგენენ ქიმიურ აგენტებს რეაქციების დასაჩქარებლად. ზოგიერთ შემთხვევაში, კატალიზატორი არის პლატინის მეტალის წვრილი ბადე.
არაორგანული მოლეკულების მაგალითები
ნატრიუმის ქლორიდი NaCl
კალიუმის ქლორიდი KCl
ამონიუმის ქლორიდი NH4კლ
ნატრიუმის ნიტრატი NaNO3
კალიუმის ნიტრატი KNO3
ამონიუმის ნიტრატი NH4არა3
გოგირდმჟავა H2SW4
ფოსფორმჟავა H3PO4
ფოსფორის მჟავა H3PO3
მარილმჟავას HCl
იოდჰიდრინის მჟავა HI
ნატრიუმის ჰიდროქსიდი NaOH
კალიუმის ჰიდროქსიდი KOH
ამონიუმის ჰიდროქსიდი NH4ოჰ
კალციუმის ჰიდროქსიდი Ca (OH)2
მაგნიუმის ჰიდროქსიდი მგ (OH)2
შავი ჰიდროქსიდი Fe (OH)2
რკინის ჰიდროქსიდი Fe (OH)3
რკინის სულფიდის FeS
შავი სულფატი FeSO4
Ferric Sulfate Fe2(SW)4)3
ორგანული მოლეკულების მაგალითები
გლუკოზა C6ჰ12ან6
მეთანი CH4
ეთანი C2ჰ6
აცეტილენი C2ჰ2
პროპანი C3ჰ8
ბუტანი C4ჰ10
ეთანოლი C2ჰ6ან
საქაროზა C12ჰ22ან11
მეთანოლი CH4ან
გლიცეროლი C3ჰ8ან3



