ქიმიური ელემენტების მაგალითი
Ქიმია / / July 04, 2021
ქიმიური ელემენტი ეს არის სუფთა ნივთიერება, რომელიც შედგება იმავე ტიპის ატომებისაგან, თავის მხრივ ჩამოყალიბდა ბირთვში მრავალი პროტონისა და ნეიტრონის მიერდა რაოდენობა ელექტრონები თავიანთ ორბიტალებში. ზოგი ბუნებრივად გვხვდება, სხვები კი ნაერთის მოლეკულების ფორმირებით, ხოლო სხვები შეიქმნა ლაბორატორიული პროცედურების ჩატარების გზით. ყველა ქიმიური ელემენტი წარმოადგენს მთლიანი სამყაროს საკითხს და ინარჩუნებს ადამიანის სხეულის არსებობასა და ფუნქციონირებას.
თითოეულ ელემენტს აქვს მახასიათებლები და ქცევა, რაც მას განასხვავებს და უნიკალურს ხდის მას, მაგრამ ამავე დროს იგი წარმოადგენს მსგავსებას ელემენტების ჯგუფთან მანიფესტაციაში, რაც მათ აქვთ სამყარო ამ მიზეზის გამო, არსებობს ქიმიური ელემენტების პერიოდული ცხრილი, რომელიც მიმართავს ამ მსგავსებებს ელემენტების თანმიმდევრული ჯგუფის დასადგენად და მათი თვისებების შესწავლის გასაადვილებლად.
ელემენტის ატომური ნომერი
ატომი ატარებს ბირთვში უამრავ პროტონს, რომელსაც თან ახლავს იგივე რაოდენობის ნეიტრონები. ამ რიცხვამდე მას ატომურ რიცხვს უწოდებენ, წარმოდგენილია როგორც
ზ აკადემიური მიზნებისთვის და ლიტერატურაში. თითოეული ელემენტისთვის ეს რიცხვი უნიკალური იქნება. არ არსებობს ერთი და იგივე ატომური რიცხვის ორი ელემენტი. პერიოდული ცხრილი ასევე ყურადღებას ამახვილებს მათი შეკვეთის ამ კრიტერიუმზე.ელემენტის სიმბოლო
ალქიმიის დროს, რომელიც დაახლოებით ჩვენს წელთ აღრიცხვამდე 400 – დან 1000 წელს ითვლის. C., ალქიმიკოსებმა ჩაწერეს თავიანთი ექსპერიმენტები ელემენტების სიმბოლოების მინიჭებისას. ეს იყო მარტივი სიმბოლოები, შესრულებული გეომეტრიული ფიგურებით, ინდივიდუალური ელემენტისა და შესწავლილი გარდაქმნების გამოსახატავად.
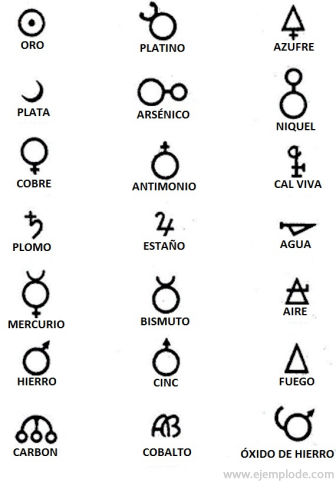
ალქიმიური სიმბოლოების რამდენიმე მაგალითი, მათ მიერ წარმოდგენილი ელემენტის ან ნაერთის სახელწოდებით.
თანამედროვე ქიმიის ეპოქაში ელემენტები კვლავ წარმოდგენილია სიმბოლოებით, ამ შემთხვევაში ასოებით, რომლებიც ლათინურად ან ინგლისურად ეხება მათ სახელს.
Მაგალითად:
ნატრიუმის სიმბოლოა ნა, მისი ლათინური სახელით ნატრიუმი
ოქროს სიმბოლოა აუ, მისი ლათინური სახელით აურუმი
ვერცხლის სიმბოლოა აღ, მისი ლათინური სახელით არგენტიუმი
სპილენძის სიმბოლოა კუ, მისი ლათინური სახელით კუპრუმი
ანთიმონის სიმბოლოა სბ, მისი ლათინური სახელით სტიბიუმი
რკინის სიმბოლოა რწმენა, მისი ლათინური სახელით ფერუმი
მერკურის სიმბოლოა Hg, მისი ლათინური სახელით Hydrargyrum, რაც ნიშნავს "თხევად ვერცხლს"
კალიუმის სიმბოლოა კ, მისი ლათინური სახელით კალიუმი
ქიმიური ელემენტების ჯგუფები:
ქიმიური ელემენტების პერიოდული ცხრილი ახდენს მათი კლასიფიკაციას ჯგუფების მიხედვით: A ჯგუფები და B ჯგუფები. A ჯგუფები რვაა, რომლებიც შეიცავს ელემენტებს ტუტე, ტუტე-მიწიერი, ტერეოსი, ელემენტების სამი ოჯახი, რომელთა უფროსი განსაზღვრავს ოჯახის სახელს: ნახშირბადის ოჯახი, აზოტის ოჯახი, გოგირდის ოჯახი, ჰალოგენები და კეთილშობილი გაზები. B ჯგუფები შედგება ყველა გარდამავალი ლითონები და იშვიათი დედამიწები, რომლებიც ასევე ორი დიდი ოჯახია: ლანთანიდები ი აქტინიდები.
IA ჯგუფი: ტუტე ელემენტები:
ტუტე ელემენტების სერია შედგება წყალბადის (H), ლითიუმის (Li), ნატრიუმის (Na), კალიუმის (K), რუბიდიუმის (Rb), ცეზიუმის (Cs) და ფრანციუმის (Fr )გან. მათ ყველას აქვთ ისეთი ელექტრონული კონფიგურაცია, რომ ბოლო გარსში აქვთ ელექტრონი. მათი სახელი განპირობებულია იმით, რომ წყალთან შეხებისას ისინი რეაგირებენ ტუტეების ან ჰიდროქსიდების წარმოქმნით. ეს არის ზოგადი ქცევა ამ ელემენტებს შორის. რაც უფრო დიდია ელემენტის ატომი, მით უფრო მეტი რეაქცია აქვს მას, ვინაიდან ძალას, რომლითაც ბირთვი ინარჩუნებს ელექტრონს ბოლო გარსიდან, სულ უფრო ნაკლები მიღწევა აქვს მათ შეუძლიათ შექმნან იონური ბონდები ჰალოგენებით. მაგალითად: იონური კავშირი, რომელსაც უხვად აქვს, არის ნატრიუმ-ქლორი, ქმნის ნატრიუმის ქლორიდს. NaCl.
IIA ჯგუფი: ტუტე-დედამიწის ელემენტები:
ეს ელემენტებია: ბერილიუმი (Be), მაგნიუმი (Mg), კალციუმი (Ca), სტრონციუმი (Sr), ბარიუმი (Ba) და რადიუმი (Ra). ისინი არ არიან თავისუფალი ბუნებით; მეორეს მხრივ, მისი კარბონატები და სილიკატები შედარებით უხვად არსებობს. ისინი არგენტინული თეთრი და კრისტალურია. ისინი ადვილად ერწყმიან ჟანგბადს ჰაერში ზემოქმედების შემთხვევაში. ეს ნაწილობრივ განპირობებულია იმით, რომ მათ უკანასკნელ გარსში ორი ელექტრონი აქვთ, რაც ჟანგბადის მიმღებლობას შეესაბამება. ბარიუმი არის ჯგუფის ყველაზე აქტიური ელემენტი და კალციუმთან ერთად ისინი ჯგუფში ყველაზე მეტად იყენებენ ინდუსტრიულ გამოყენებას.
ჯგუფი IIIA: დედამიწის ელემენტები:
IIIA ჯგუფი მოიცავს ბორის (B), ალუმინის (Al), გალიუმის (Ga), ინდიუმის (In) და ტალიუმის (Tl) ელემენტებს. ბორი არალითონური ელემენტია, ალუმინის არის ამფოტერული (ამფიპროტიკური), ანუ მას შეუძლია იმოქმედოს როგორც მჟავა და როგორც ფუძე; და დანარჩენი სამი მეტალის ელემენტებია. მათ უკანასკნელ გარსში სამი ელექტრონი აქვთ, რაც წარმოქმნის ვალენტობას +3, თუმცა ზოგჯერ გალიუმი მოქმედებს +1 და +2 ვალენტობით მის ზოგიერთ ნაერთში. ბორი ერთადერთი ელემენტია ამ სერიაში, რომელიც ქმნის ჰიდრიდებს. ბორი და ალუმინი ქმნიან კარბიდებს.
IVA ჯგუფი: ნახშირბადის ოჯახი:
IVA ჯგუფის წარმომადგენლობითი ელემენტებია ნახშირბადი (C), სილიციუმი (Si), გერმანიუმი (Ge), კალე (Sn) და ტყვია (Pb). პირველი ორი თავისებურებით ძირეულად არალითონურია, მაგრამ გერმანიუმი, კალის და ტყვიის მეტალიკია და მით უფრო მეტია მათი ატომური რიცხვი. სილიციუმის გარდა, თითოეულ ელემენტს აქვს ვალენსიები +4 და +2.
ნახშირბადი და სილიციუმი ქმნიან ნაერთებს, რომლებშიც ელემენტების ატომები უერთდება ელექტრონულ წყვილებს. ნახშირბადი არის ორგანული ნაერთების არსი წყალბადის, ჟანგბადის, აზოტის, გოგირდის და ზოგჯერ სილიციუმის ატომებთან ასოცირებით.
სილიციუმი და გერმანიუმი გამოიყენება ელექტრონული კომპონენტების წარმოებისათვის, რადგან მათ აქვთ თვისება მოიქცნენ როგორც ნახევარგამტარები.
VA ჯგუფი: აზოტის ოჯახი:
VA ჯგუფში შედის აზოტი (N), ფოსფორი (P), დარიშხანი (როგორც), სტიბიუმი (Sb) და ბისმუთი (Bi). აზოტი და ფოსფორი არალითონურია, დარიშხანი და სტიბიუმი მეტალოიდებია, ხოლო ბისმუთი ლითონია. ამ ელემენტებს ახასიათებს ჰიდრიდების წარმოქმნა, რომელთაგან ყველაზე ნაკლებად ტოქსიკურია ამიაკი NH3. აზოტი ქმნის აზოტის მჟავას HNO3, ჩართულია მარილმჟავასთან ერთად Agua Regia, ნარევი, რომელსაც შეუძლია დაითხოვოს ძვირფასი ლითონები, როგორიცაა ოქრო და ვერცხლი.
აზოტი ასევე მონაწილეობს ორგანულ ნაერთთა ორ დიდ ჯგუფში, სახელწოდებით ამინები და ამიდები, რომლებიც შეიძლება ჩაითვალოს ამიაკის NH წარმოებულებად.3წყალბადის ნახშირწყალბადების ჯაჭვით ჩანაცვლებით.
VIA ჯგუფი: ჟანგბადის ოჯახი:
შედგება ელემენტები ჟანგბადი (O), გოგირდი (S), სელენი (Se), ტელურიუმი (Te) და პოლონიუმი (Po). ჟანგბადი ყველაზე აქტიურია და აქვს კოვალენტური ობლიგაციების ადვილად წარმოქმნის უნარი. მაღალ ტენიანობის გარემოში მეტალებთან შეხებისას წარმოიქმნება ოქსიდები. იგი ქმნის რეზონანსულ მოლეკულას, რომელსაც ეწოდება ოზონი, რომელიც იცავს პლანეტას UV გამოსხივებისგან.
ჯგუფი VIIA: ჰალოგენები:
მისი სახელი ნიშნავს "გაყიდვების შემქმნელებს". ჯგუფი შედგება ელემენტები Fluor (F), Chlorine (Cl), Bromine (Br), Iodine (I) და Astate (At). მათ ბოლო გარსში შვიდი ელექტრონი აქვთ, რაც მათ საშუალებას აძლევს იყვნენ ერთი ელექტრონის რეცეპტორები. ეს ხარისხი აიძულებს მათ დააკავშირონ IA ჯგუფის ელემენტებს და წარმოქმნან ორობითი მარილები. ფტორს ახასიათებს მთელი პერიოდული ცხრილიდან ყველაზე დიდი ელექტრონეგატივა, რომლის ღირებულებაა 4.0, მისი ანალოგია ცეზიუმი, 0.7 ელექტრონეგატივით. ეს თვისება საშუალებას აძლევს მას ჰქონდეს ძალა სხვა ატომების მოსაზიდად და უპირატესობა მიანიჭოს მასთან კავშირის შექმნას ისინი
VIIIA ჯგუფი: კეთილშობილი გაზები:
ინერტული გაზის ჯგუფს ასევე უწოდებენ ჰელიუმის (ის), ნეონის (ნე), არგონის (არ), კრიპტონის (კრ), ქსენონის (ქს) და რადონის (რა) ელემენტებისგან. ისინი არიან ის ელემენტები, რომლებსაც აქვთ თავიანთი სრული ელექტრონული კონფიგურაცია, ამიტომ მათ არ შეუძლიათ რეაგირება ჩვეულ პირობებში. ისინი ძირითადად გამოიყენება შუქმფენი კომერციული ნიშნებისთვის, რომლებიც ასხივებენ ხილულ სინათლეს, როდესაც მათზე ელექტროენერგია ხდება.
ჯგუფები B: გარდამავალი მეტალები:
თითოეული სამი ელემენტის ათი ჯგუფში გარდამავალი მეტალები დაჯგუფებულია. ეს მოიცავს საუკეთესო ელექტროგამტარებს: ვერცხლი (Ag), სპილენძი (Cu), ოქრო (Au); საუკეთესო კონსტრუქციული კომპონენტები ურბანული მშენებლობისა და ინჟინერიისთვის; რკინა (Fe), ტიტანი (Ti), ალუმინი (Al), ცირკონიუმი (Zr), ვოლფრამი (W); საუკეთესო კატალიზატორის კომპონენტები: ნიკელი (Ni), ვანადიუმი (V), პლატინა (Pt); და საიზოლაციო ძირითადი ინგრედიენტები: კადმიუმი (Cd), ქრომი (Cr), თუთია (Zn). ისინი ჩვეულებრივ უმკლავდებიან ვალენტობას +1 და +3 შორის, მაგრამ ისეთი ელემენტები, როგორიცაა Chromium, ამუშავებენ ვალენსიებს +2, +3, +6.
იშვიათი დედამიწა: ლანთანიდები და აქტინიდები:
მათ პლანეტაზე სიმცირის გამო იშვიათ მიწებს უწოდებენ. ისინი შედგება ორი ჯგუფისგან: ლანთანიდები და აქტინიდები. ისინი გვხვდება პერიოდული ცხრილის ორ ცალკეულ ხაზზე. ისინი ზოგადად +3 ვალენტობით მუშაობენ და ჰიდროქსიდების წარმოქმნას ცდილობენ. მათ შორის ყველაზე მნიშვნელოვანი ელემენტია ცერიუმი, რომელსაც იყენებენ პიროფორული შენადნობების მოსამზადებლად (შენადნობი) არასწორისანთებლების ქვებისთვის), გაზების შლანგებში განათებისთვის და სპეციალური სათვალეების წარმოებისთვის, რომლებიც შთანთქავენ ულტრაიისფერ სხივებს და სითბოს გამოსხივებას.
ყველაზე ძლიერი რადიოაქტიური ელემენტები, როგორიცაა ურანი (U) და პლუტონიუმი (Pu), ამ ჯგუფების ნაწილია. მათი არასტაბილურობის გათვალისწინებით, ენერგიას უშვებენ და იშლება, კარგავენ ალფა ნაწილაკებს (ბირთვები) ჰელიუმი). მოგვიანებით, ისინი რადიაქტიური სერიების თანახმად, ნაკლებად არასტაბილური ელემენტები ხდებიან.

