კოვალენტური ბონდის მაგალითი
Ქიმია / / July 04, 2021
Კოვალენტური ბმა არის ის, რომელშიც ორი ატომი გაერთიანდება მათი ელექტრონების გაზიარებით, წავიდეთ ოქტეთის წესების შესასრულებლად.
კოვალენტური ობლიგაციის ისტორია
სწორედ მე -20 საუკუნის დასაწყისში დაიწყეს ქიმიკოსების გაგება, თუ როგორ და რატომ წარმოიქმნა მოლეკულები. პირველი მნიშვნელოვანი გარღვევა შემოვიდა წინადადებით გილბერტ ლუისი რის შესახებ ქიმიური ბმის წარმოქმნა გულისხმობს იმას ატომებს ელექტრონები აქვთ. ლუისმა აღწერა წყალბადის ქიმიური კავშირის წარმოქმნა, როგორც:
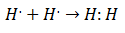
ამ ტიპის ელექტრონების დაწყვილება წარმოადგენს კოვალენტური ობლიგაციის მაგალითს, კავშირი, რომელშიც არის ორ ელექტრონს ორი ატომი ანაწილებს. კოვალენტური ნაერთები ისინი რომ არიან შეიცავს მხოლოდ კოვალენტურ ობლიგაციებს.
ელექტრონები კოვალენტურ ობლიგაციაში
სიმარტივისთვის, საერთო ელექტრონული წყვილი ხშირად წარმოდგენილია როგორც ერთი ხაზი ელემენტების სიმბოლოების დამაკავშირებელი. ამრიგად, წყალბადის მოლეკულის კოვალენტური კავშირი იწერება როგორც H-H.
კოვალენტურ კავშირში, საერთო ელექტრონული წყვილის თითოეული ელექტრონი იზიდავს ორივე ატომის ბირთვები. ამ ატრაქციონში ორი ატომია მოთავსებული H მოლეკულაში.
2 და ის პასუხისმგებელია სხვა მოლეკულებში კოვალენტური ბმების წარმოქმნაზე.რამდენიმე ელექტრონის ატომებს შორის კოვალენტურ კავშირებში მხოლოდ ვალენტობის ელექტრონები მონაწილეობენ, რომლებიც ყველაზე შორს არიან, არაღრმა ორბიტალში. მათგან ერთიდან სამამდე მიიღებს მონაწილეობას კავშირში.
სხვა ელექტრონებს, რომლებიც არ მონაწილეობენ კავშირში, ეწოდება არააკავშირებელი ელექტრონები, ან თუ მათ წყვილებად ვაწყობთ, უფასო წყვილი. ეს არის ვალენსიის ელექტრონების წყვილი არ მიიღოთ მონაწილეობა კოვალენტური ობლიგაციების ფორმირებაში.
კოვალენტური ობლიგაციების წარმომადგენლობა
სტრუქტურები, რომლითაც წარმოდგენილია კოვალენტური ნაერთები, მაგალითად H2 და ფ2 ცნობილია როგორც ლუისის სტრუქტურები. ლუისის სტრუქტურა არის ა კოვალენტური ბმის წარმოდგენა, სადაც წყვილი ელექტრონებია მითითებულია ხაზებით ან წერტილების წყვილი ორ ატომს შორის, და გაზიარებული თავისუფალი წყვილი მითითებულია როგორც ინდივიდუალური ატომების წერტილების წყვილი. ლუისის სტრუქტურაში ნაჩვენებია მხოლოდ ვალენტობის ელექტრონები და არა შინაგანი.
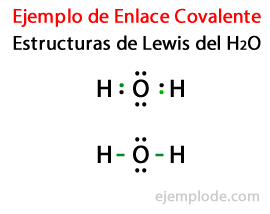
წყლის მოლეკულისთვის ლუისის სტრუქტურის გათვალისწინებით H2ან, წყალბადის და ჟანგბადის ატომების ყველა ვალენტური ელექტრონი პირველად აღინიშნება წერტილებით.
მეორე შემთხვევაში, ბმული აღინიშნება ხაზით. და თავისუფალი წყვილები, რომლებიც მხოლოდ ჟანგბადში იარსებებს, წერტილებით.
ოქტეტის წესი
ამ მოლეკულების წარმოქმნა, ისევე როგორც წყლის H– ს2ან, ზარის ილუსტრირება ოქტეტის წესი, შემოთავაზებული ლუისის მიერ: წყალბადის გარდა სხვა ატომი ცდილობს შექმნას ობლიგაციები მანამ, სანამ არ შემოიხვევს თავს რვა ვალენტური ელექტრონიანუ, კოვალენტური კავშირი წარმოიქმნება, როდესაც არ არის საკმარისი ელექტრონები თითოეული ცალკეული ატომისთვის, რომ შეავსოს მისი ოქტეტი.
ელექტრონების კოვალენტურ კავშირში გაყოფით, თითოეული ატომი ასრულებს თავის ოქტეტს. წყალბადისთვის მოთხოვნაა მიიღოთ ჰელიუმის ელექტრონული კონფიგურაცია, რომელიც უნდა ჰქონდეს სულ ორი ელექტრონი.
ოქტეტების წესი ძირითადად მუშაობს პერიოდული ცხრილის მეორე პერიოდის ან მწკრივის ელემენტებისათვის. ამ ელემენტებს აქვთ ქვედონეები, რომელშიც შეიძლება სულ რვა ელექტრონი იყოს.
როდესაც ამ ელემენტების ატომი ქმნის კოვალენტურ ნაერთს, იგი იღებს ნეონის სათავადო აირის ელექტრონულ კონფიგურაციას, ანაწილებს ელექტრონებს სხვა ატომებთან იმავე შემადგენლობაში.
კოვალენტური ობლიგაციების ტიპები
ატომებს შეუძლიათ შექმნან სხვადასხვა ტიპის კოვალენტური ობლიგაციები: სინგლები, დუბლები ან სამეული.
Ში მარტივი ბმული, ორი ატომი გაერთიანებულია საშუალებით ელექტრონების წყვილი. ისინი გვხვდება კოვალენტური ნაერთების აბსოლუტურ უმრავლესობაში და ეს ამ კავშირის ყველაზე ძირითადი ფორმაა.
ბევრ ნაერთებში, ორმაგი ბმულები, ანუ, როდესაც ორი ატომი იზიარებს ელექტრონების ორი წყვილი. თუ ორ ატომს ორი წყვილი ელექტრონი აქვს, კოვალენტურ კავშირს ორმაგ ბმას უწოდებენ. ეს კავშირები გვხვდება ნახშირბადის დიოქსიდის (CO) მოლეკულებში2) და ეთილენის (C2ჰ4).

ა სამმაგი ბმული ჩნდება, როდესაც ორი ატომი იზიარებს ელექტრონების სამი წყვილი, როგორც აზოტის მოლეკულაში N2, აცეტილენ C– ს მოლეკულა2ჰ2.

მრავალჯერადი ობლიგაციები უფრო მოკლეა ვიდრე ერთ კოვალენტური ობლიგაციები. ბმულის სიგრძე განისაზღვრება, როგორც მანძილი ორი შეერთებული ატომის ბირთვს შორის კოვალენტური ბმით მოლეკულაში.
განსხვავებები კოვალენტურ და იონურ ნაერთებს შორის
იონური და კოვალენტური ნაერთები აშკარად განსხვავდებიან მათი ზოგადი ფიზიკური თვისებებით, იმის გამო, რომ მათი კავშირები განსხვავებული ხასიათისაა.
იმ კოვალენტური ნაერთები არსებობა ორი ტიპის მიმზიდველი ძალა; ერთი მათგანია ერთი, რომელიც აერთიანებს მოლეკულის ატომებს. ამ მიზიდულობის რაოდენობრივი საზომი არის სავალდებულო ენერგია. მოზიდვის სხვა ძალა მოქმედებს სრულ მოლეკულებს შორის და ეწოდება ინტერმოლეკულური ძალა. მას შემდეგ, რაც ინტერმოლეკულური ძალები, როგორც წესი, უფრო სუსტებია, ვიდრე მოლეკულის ატომები ერთად შეკავებული ძალები, კოვალენტური ნაერთის მოლეკულები ნაკლები ძალებით იერთებენ.
ნაკურთხი, კოვალენტური ნაერთები თითქმის ყოველთვის არის დაბალი დნობის გაზები, სითხეები ან მყარი ნივთიერებებინ მეორეს მხრივ, ელექტროსტატიკური ძალები, რომლებიც იონებს ერთმანეთთან იკავებენ იონურ ნაერთში ისინი, როგორც წესი, ძალიან ძლიერია, ისე რომ იონური ნაერთები მყარი იყოს ოთახის ტემპერატურაზე და ჰქონდეს დნობის მაღალი წერტილები. მრავალი იონური ნაერთი იხსნება წყალში და მათი წყალხსნარები ატარებენ ელექტროენერგიას, რადგან ეს ნაერთები ძლიერი ელექტროლიტებია.
Უმეტესი კოვალენტური ნაერთები წყალში არ იხსნებადა თუ ისინი დაითხოვენ, მისი წყალხსნარები როგორც ყოველთვის ისინი არ ატარებენ ელექტროენერგიას რადგან ეს ნაერთები არის არაელექტროლიტები. მდნარი იონური ნაერთები ელექტროენერგიას ატარებენ, რადგან ისინი შეიცავს კატიონებსა და ანიონებს, რომლებიც თავისუფლად მოძრაობენ; თხევადი ან მდნარი კოვალენტური ნაერთები არ ატარებენ ელექტროენერგიას, რადგან იქ არ არის იონები.
კოვალენტურად შეკრული ნაერთების მაგალითები
- აცეტილენი C2ჰ2
- მეთანი CH4
- ეთანი C2ჰ6
- პროპანი C3ჰ8
- ბუტანი C4ჰ10
- ბენზოლი C6ჰ6
- ტოლუოლი C7ჰ8
- მეთილის ალკოჰოლი CH3ოჰ
- ეთილის ალკოჰოლი C2ჰ5ოჰ
- პროპილის ალკოჰოლი C3ჰ7ოჰ
- მეთილის ეთერი CH3OCH3
- მეთილის ეთილ ეთერი C2ჰ5OCH3
- ეთილის ეთერი C2ჰ5OC2ჰ5
- ფორმალური მჟავა HCOOH
- ძმარმჟავა CH3COOH
- პროპიონის მჟავა C2ჰ5COOH
- Butyric Acid C3ჰ7COOH
- ნახშირბადის დიოქსიდი CO2
- ნახშირბადის მონოქსიდი CO
- მოლეკულური აზოტი N2
- მოლეკულური წყალბადის H2

