산, 염기 및 염은 어떻게 형성됩니까?
잡집 / / July 04, 2021
정의하는 몇 가지 이론이 있습니다. 산 그리고 기지그중에는 Arrhenius, Brönsted-Lowry 및 Lewis가 있습니다.
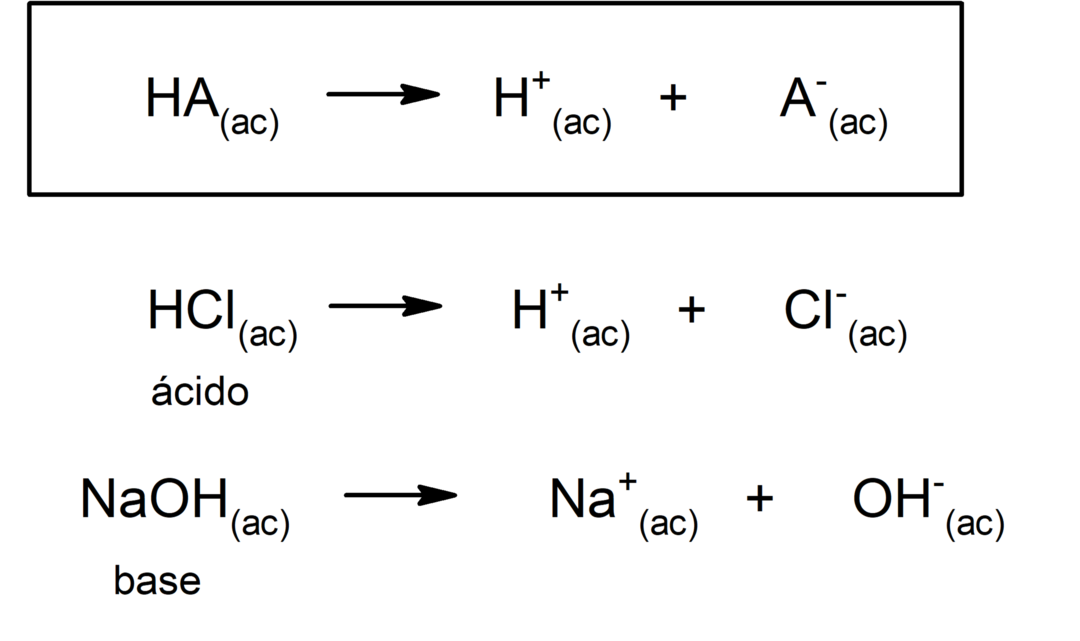
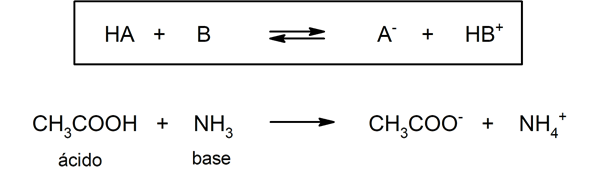
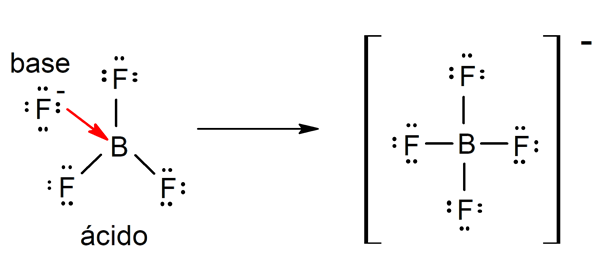
유형 산 산화제 일반적으로 반응 물과 비금속 산화물 사이에 수소산 조합에 의해 형성됩니다 비금속 수용액에 수소로. 예를 들면 :황산 (H2SW4) 그것은 oxacid이고 염산 (HCl(ac)) 그것은 수소산.
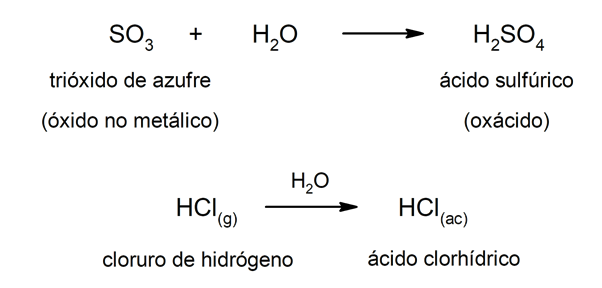
반면에 염기는 다음과 같은 반응의 결과로 형성 될 수 있습니다. 금속 산화물 그리고 물. 예를 들면: 수산화 마그네슘 (Mg (OH)2).
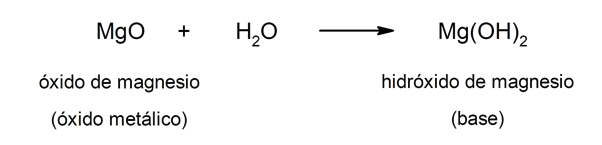
산과 염기의 일반적인 특성
일반적으로 산은 신맛과 부식성. 기지는 또한 신랄한, 쓴맛이 나고, 피부에 닿으면 부식성이 있고 비눗물을 띕니다. 반면에 산 용액에는 pH 7 미만인 반면 염기 용액의 pH는 7 이상입니다.
산 및 염기 강도
그만큼 산의 경향 해리하고 pH를 낮추는 것을 종종 "산 강도"라고합니다. 산은 수용액에서 완전히 해리 될 수있을 때 강하고 부분적으로 해리 될 때 약하다. 강산의 예로는 과염소산 (HClO4), 황산 (H2SW4), 요오드화 수소 (HI), 브롬화 수소 (HBr), 염산 (HCl) 및 질산염 (HNO3). 반면에 아세트산 (CH3COOH), 감귤류 (C6H8또는7) 및 벤조산 (C6H5COOH) 약합니다.
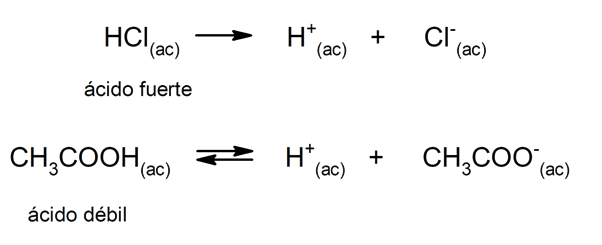
마찬가지로 다음과 같이 간주 할 수 있습니다. 강력한 기지 수용액에서 완전히 해리되고 부분적으로 해리가 발생하면 약한 것. 강염기의 예로는 수산화 칼륨 (KOH), 나트륨 (NaOH), 리튬 (LiOH) 및 마그네슘 (Mg (OH))이 있습니다.2). 반면에 암모니아 (NH3)은 약한 염기입니다.
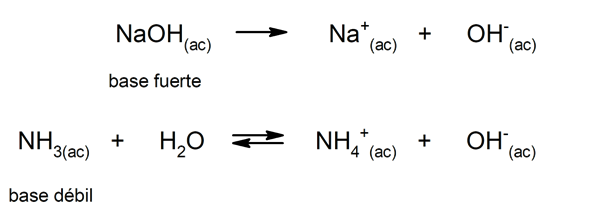
소금은 어떻게 형성됩니까?
그만큼 너 나가 다양한 복잡도의 이온 화합물이며, 자연적으로 풍부하며 일반적으로 형성됩니다. 중화 반응에서 산과 염기의 조합에 의해 물. 그들은 또한 금속과 산, 금속과 비금속의 반응 또는 다른 염 사이의 반응의 결과로 형성 될 수 있습니다.
염은 다음과 같이 분류 할 수 있습니다.
배포 및 중요성
산은 다음에서 매우 중요합니다. 산업 처럼 자연. 예를 들어, 염산은 소화 시스템의 일부이며 우리가 소화 기관에 존재하는 영양 성분을 분해하는 데 필요합니다.
음식. DNA로 더 잘 알려진 Deoxyribonucleic acid는 염색체를 구성하며, 염색체를 암호화하는 데 필요한 유전 정보는 살아있는 생명체 번식하고 발전하십시오. 붕산은 유리 산업에서 두드러진 성분입니다.그만큼 탄산 칼슘 다양한 종류의 석회암 암석에 매우 풍부한 소금입니다. 높은 점유율로 온도 탄산 칼슘, 산화 칼슘 또는 생석회에서 (900 ° C) 얻을 수 있습니다. 생석회에 물을 첨가하면 염기 인 소석회라고하는 수산화칼슘이 생성됩니다. 이들 기재 그들은 건설에 사용됩니다.
따르십시오 :

