정의 ABC의 개념
잡집 / / April 22, 2022
개념 정의
공비혼합물은 특정 온도에서 끓는 정의된 조성을 가진 화합물의 혼합물입니다. 근본적인 특징은 혼합물이 마치 하나의 순수한 물질처럼 행동하여 특성을 보존하고 취급이 용이하다는 것입니다.

화학 공학 기술자
혼합물은 둘 이상의 성분으로 주어질 수 있으며, 구성 액체상과 기체상 모두 동일하며, 이는 순수한 물질과 유사성을 생성합니다. 이것으로부터, 이 혼합물은 위에서 언급했듯이 분별 증류는 단일 제품처럼 행동하여 비율을 유지합니다. 요소.
또 다른 특징은 이 혼합물의 끓는점이 구성 요소 중 하나의 끓는점보다 높거나 낮거나 같을 수 있다는 것입니다. 공비 혼합물이 끓을 때 온도 최대 끓는점을 최대 공비(maximum azeotrope)라고 하고, 가능한 가장 낮은 온도에서 끓는 것을 최소 공비(minimum azeotrope)라고 합니다. 이것은 최소 공비 혼합물이 순수한 성분보다 끓는점이 낮고 그 반대의 경우 최대 공비 혼합물이 있음을 의미합니다. 예를 들어, 메탄올 - 벤젠 혼합물에서 공비혼합물은 최소입니다(0.61 벤젠 - 0.39 메탄올 분획 몰) 끓는점이 58 °C이고 벤젠의 끓는점이 80 °C이고 메탄올의 끓는점이 있는 탱크 65°C
최소 및 최대 공비
자... 공비혼합물은 어디에서 왔습니까? 편차가 있을 때 법 Raoult, 즉 공비 혼합물의 증기압은 몰 분율과 직접적인 관련이 없으며 공비 혼합물의 개념이 발생하는 경우입니다. 이러한 편차는 구성 요소가 서로 상당히 끌어당기거나 밀어낼 때 발생합니다. 즉, 분자간 힘이 다른 화합물에서 매우 다를 때 발생합니다.
편차가 양수이면 최소 공비를 가지며, 편차가 음수이면 최대 공비를 갖습니다. 이 개념을 더 잘 이해하기 위해 몇 가지 그래픽을 살펴보겠습니다.
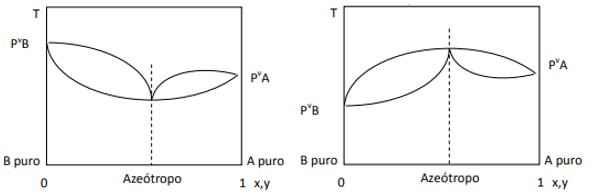
여기서 우리는 혼합물이 이상적이라면 Raoult의 법칙에 따라 순수한 성분의 증기압이 직선으로 연결되어야 함을 관찰합니다. 글쎄요, 최소 및 최대 공비혼합물의 형성을 일으키는 법칙과의 편차가 있습니다. 구성 요소. 왼쪽 그림과 같이 Raoult의 법칙에 대한 편차가 음수일 때 최소값입니다.
도표 압력의 최대값이지만 온도 도표에서는 최대값입니다(따라서 최대값의 공비혼합물). 반면 편차가 Raoult의 법칙에 양수이면 압력 대 압력에서 최대가 됩니다. 구성이지만 온도 대 다이어그램의 최소값입니다. 구성(여기에는 최소 공비혼합물이 있습니다). 압력과 다이어그램을 혼동하지 마십시오. 구성 및 온도 대 구성.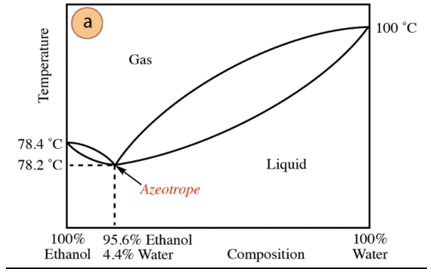
에탄올-물 혼합물의 경우 조성이 95.6% 에탄올과 4.4% 물인 최소 공비혼합물이 있습니다. 공비 혼합물의 끓는 온도는 순수한 성분의 끓는 온도보다 78.2 °C 낮습니다. 따라서 수분 함량이 높은(100%에 가까운) 물-에탄올 혼합물을 증류한다고 가정합니다. 각 증류 단계에서 더 많은 분획이 얻어지기 때문에 순수한 알코올을 얻는 것은 불가능합니다. 에탄올의 농도가 100%에 도달하지 않으면 점차적으로 공비 혼합물의 조성에 접근합니다(최저점 아래에). 그렇기 때문에 물과 마찬가지로 최소 공비혼합물을 형성하는 경향이 있습니다. 유기 화합물 (상호 작용하는 분자간 힘의 유형을 감안할 때) 순수한 화합물을 얻으려면 혼합물에서 미리 물을 제거해야합니다. 또는 일단 공비혼합물이 얻어지면 추출 추가 물.
위의 내용을 바탕으로 알코올을 발견하는 것은 우연이 아닙니다(슈퍼마켓 및 약국) 95%에서 얻을 수 있는 가장 저렴한 제품입니다. 순수한 알코올을 얻으려면 공비혼합물을 기술 건조제 또는 공비 증류의 사용과 같은 추가. 공비 증류는 비말동반에 의해 작용하는 혼합물에 추가 성분을 추가하는 것으로 구성됩니다. 상호 작용 혼합물의 구성 요소 중 하나를 사용하여(높은 친화도) 혼합물에서 제거할 수 있습니다.
Azeotropes의 주제