20가지 아민의 예
예 / / November 06, 2023
그만큼 아민 ~이다 유기 화합물 암모니아 유도체(NH3), 여기서 암모니아의 수소 중 적어도 하나가 알킬 또는 아릴 그룹으로 대체되어 아미노 그룹(-NH)이 형성됩니다.2, -NH-, -N=). 예를 들어:메틸아민, 에틸아민 및 프로필아민.

알킬기는 포화 탄화수소에서 수소가 제거될 때 형성되는 치환기입니다. 이런 식으로, 수소가 분리된 탄소는 다른 탄소와 결합할 수 있습니다. 원자. 예: 메틸(CH3 -) 및 에틸(CH3 – CH2 -).
아릴 그룹은 벤젠과 같은 방향족 고리에서 파생된 치환기입니다. 예: 페닐(C6시간5 -)
- 참조: 아미드
아민의 종류
아민은 알킬 또는 아릴 작용기로 대체된 질소에 결합된 수소 원자의 수에 따라 분류될 수 있습니다.
이 기준에 따르면 다음과 같습니다.
- 1차 아민. 암모니아의 수소 원자 중 하나만이 알킬 또는 아릴 그룹으로 대체될 때 형성됩니다. 예를 들어: 에틸아민과 1-펜틸아민.
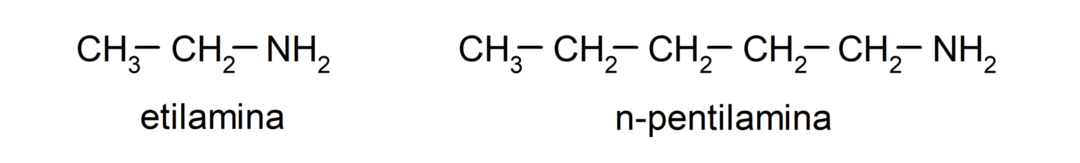
- 2차 아민. 암모니아의 수소 원자 중 두 개가 알킬 또는 아릴 그룹으로 대체될 때 형성됩니다. 예를 들어: 디에틸아민과 에틸메틸아민.
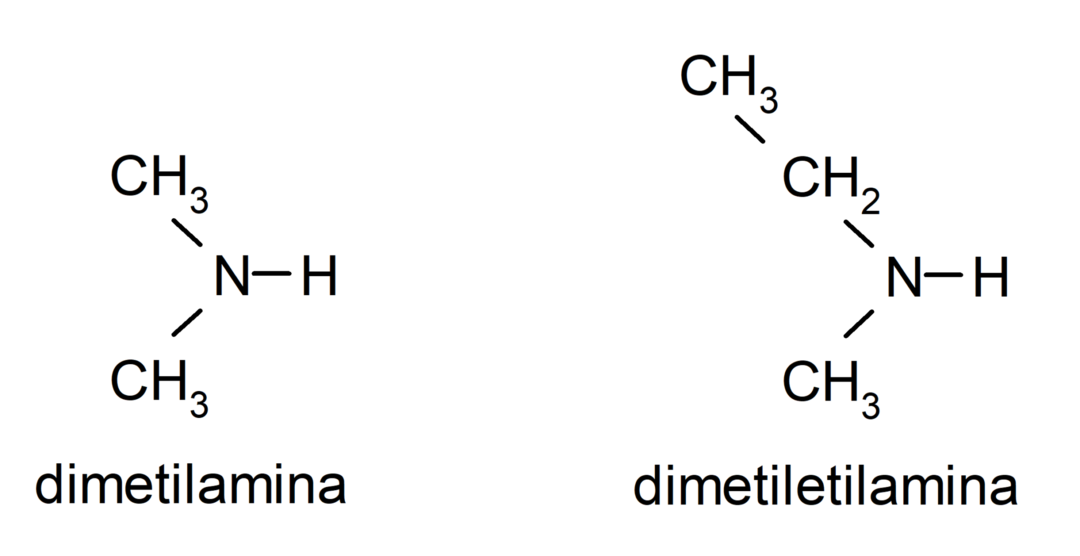
- 3차 아민. 암모니아의 세 개의 수소 원자가 알킬 또는 아릴 그룹으로 대체될 때 형성됩니다. 예를 들어: 트리메틸아민과 디메틸에틸아민.
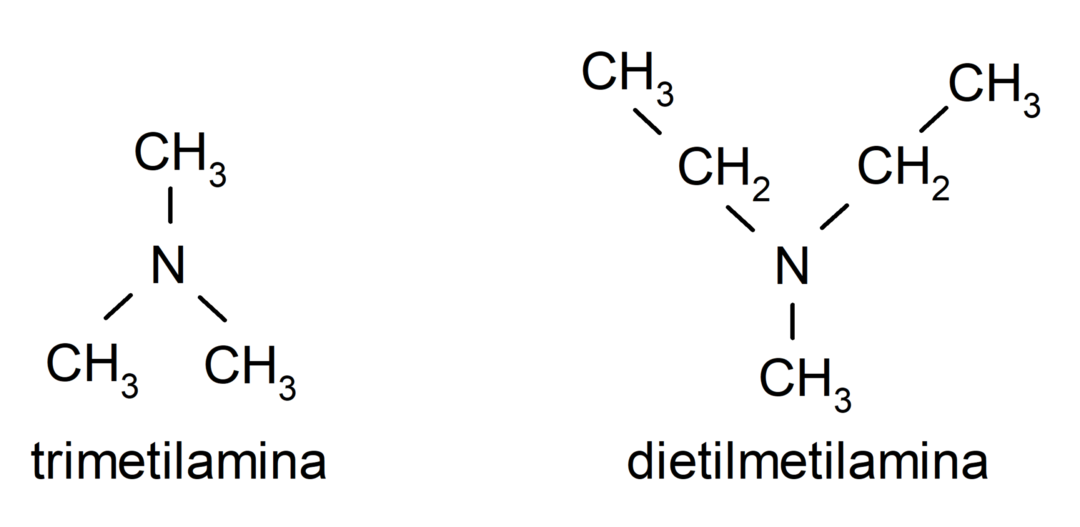
아민은 또한 질소에 결합된 그룹의 유형에 따라 분류됩니다. 이 기준에 따르면 다음과 같습니다.
- 지방족 아민. 그들은 알킬 치환기를 가지고 있습니다. 예를 들어: 부틸아민과 디에틸아민.

- 방향족 아민. 그들은 아릴 치환기를 가지고 있습니다. 예를 들어: 페닐아민(아닐린) 및 디페닐아민.
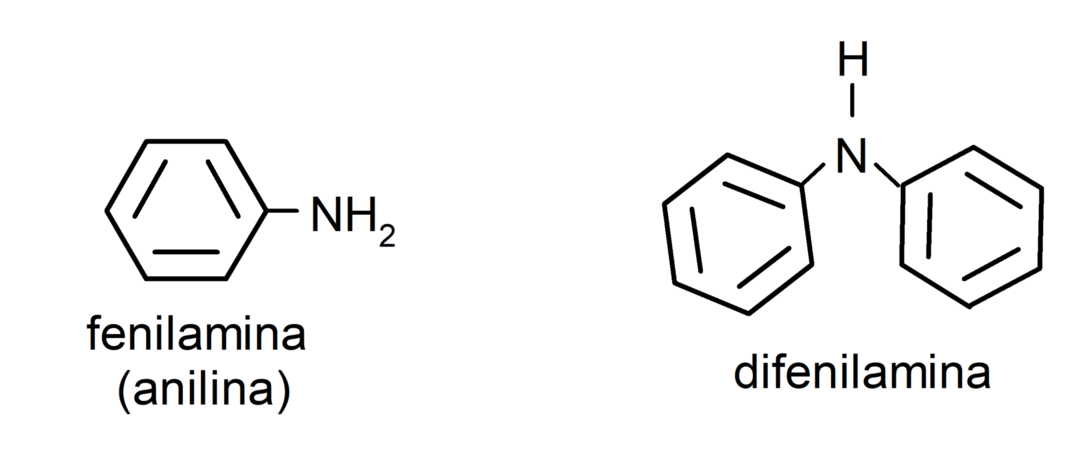
아민의 명명법
IUPAC(국제 순수 및 응용 화학 연합)에 따르면 아민은 다음 규칙에 따라 명명됩니다.
가장 단순한 아민의 경우 암모니아 질소에 결합된 수소 그룹의 각 치환기가 명명됩니다. 그런 다음 "amine"이라는 단어가 이름 끝에 배치됩니다.
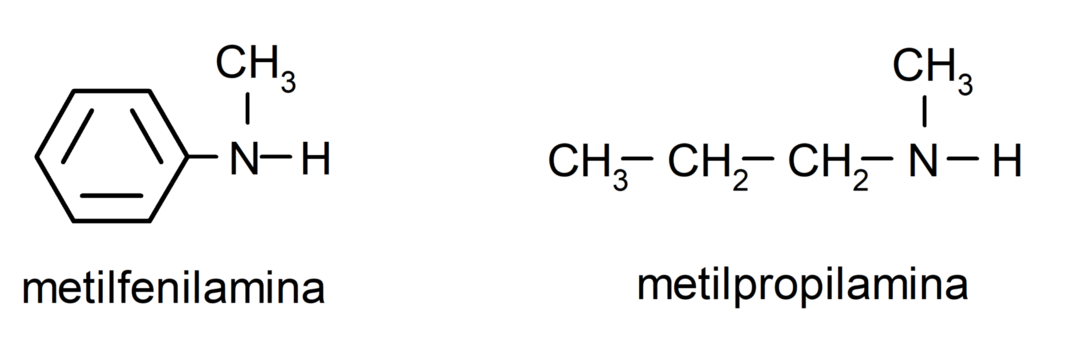
여러 개의 탄소 사슬(다른 치환기를 가짐)을 포함하는 아민의 경우 아미노기를 포함하는 탄소 사슬이 주요 사슬로 선택됩니다. 또한, 아미노 그룹의 위치는 탄소 사슬에서 가장 작은 위치를 차지하도록 선택됩니다. 이 위치를 기반으로 치환체도 선택되어 해당 위치에서 가능한 가장 작은 위치를 차지합니다. 체인.
마지막으로 주쇄에 해당하는 알칸, 알켄, 알킨의 명칭을 사용하여 명명하고, 접미사 아민을 붙인다.
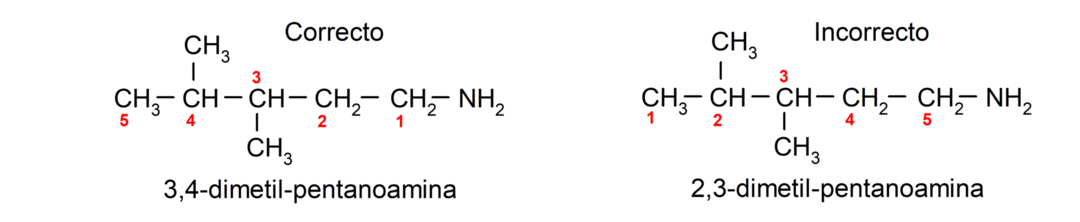
탄소 사슬에 여러 개의 아미노기가 포함되어 있는 경우 위치 번호의 가장 작은 조합에서 차지하는 위치에서 선택됩니다. 또한, 해당 알칸, 알켄, 알킨의 명칭을 붙이고, 그 뒤에 아미노기의 수를 나타내는 용어를 붙인 뒤, 접미사 “아민”을 붙인다.

아민의 물리적 특성
아민의 물리적 특성은 질소에 부착된 수소가 얼마나 많이 치환되었는지, 그리고 어떤 유형의 치환기로 치환되었는지에 따라 크게 달라집니다.
- 용해도. 일반적으로 아민은 해당 포화 탄화수소보다 물에 더 잘 녹습니다. 또한, 긴 탄소 사슬을 가진 아민은 짧은 탄소 사슬을 가진 아민보다 물에 덜 용해됩니다. 반면에 방향족 아민은 물에 녹지 않습니다.
- 비점. 아민의 끓는점은 같은 수의 탄소 원자를 가진 알칸의 끓는점보다 높습니다.
- 냄새가 나다. 대부분의 아민에는 불쾌한 냄새가 있습니다. 예를 들어, 푸트레신은 고기 썩는 냄새가 나고 트리메틸아민은 생선 썩는 냄새가 납니다.
아민의 화학적 성질
아민의 일부 화학적 특성은 다음과 같습니다.
- 이들은 기본적인 화합물이며, 즉, Brønsted-Lowry 이론에 따라 양성자를 받아들이는 반응을 겪습니다. 예를 들어:
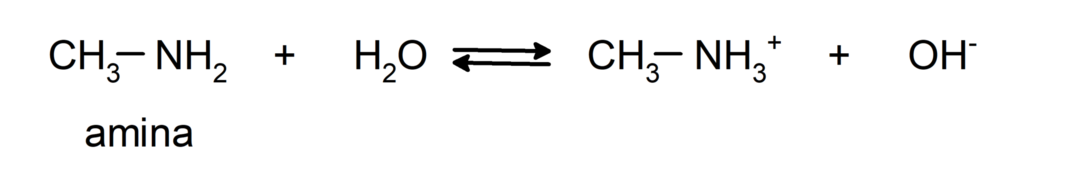
- 중화 반응을 나타냅니다. 아민 염이 형성되는 산과 함께. 예를 들어:

아민의 예
- 메틸아민
- 에틸아민
- 프로필아민
- 디메틸아민
- 에틸메틸아민
- 페닐아민(아닐린)
- 디페닐아민
- 메틸프로필아민
- 부탄-1,4-디아민
- 스페르민
- 카다베린
- 3,5-디메틸아닐린
- 메틸아닐린
- 암페타민
- 피페라진


아민의 생물학적 기능
아민은 여러 곳에 존재합니다. 살아있는 생명체 그리고 다양한 기능을 수행합니다. 에피네프린, 노르에피네프린, 세로토닌, 도파민과 같은 일부 아민은 신경 전달 물질입니다.
아미노기는 아미노산을 형성하는 작용기 중 하나로, 아미노산의 기본 단위이다. 단백질. 또한 DNA와 RNA를 구성하는 질소 염기에는 아미노기가 포함되어 있습니다.
아민의 용도
아민의 일부 용도는 다음과 같습니다.
- 이들은 농약 및 제약 화합물을 생산하는 데 사용됩니다.
- 이들은 폴리우레탄 생산에서 촉매로 사용됩니다.
- 감쇠 효과로 인해 수성 환경에서 부식을 억제하는 데 사용됩니다.
- 발전소와 정유소에서 가스를 정화하는 데 사용됩니다.
- 그들은 청소 제품을 만드는 데 사용됩니다.
- 비누와 샴푸의 거품을 개선하기 때문에 개인 관리 제품을 생산하는 데 사용됩니다.
아민 독성
고농도의 아민을 흡입하면 중독이 발생하여 혈압이 상승하고 발작이 발생합니다. 또한, 지방족 아민과 접촉하면 기체 상태 눈과 호흡기에 자극을 일으킵니다. 몇몇 아민은 접촉 시 피부 화상을 유발합니다.
방향족 아민은 독성이 매우 높지만 지방족 아민보다 휘발성이 훨씬 낮기 때문에 접촉을 더 잘 제어할 수 있습니다.
참고자료
- 페레즈, C. 아르 자형. C., & 히메네스-콜메네로, F. (2010). 생체 아민: 독성학적 중요성. 전자. 제이. Biomed., 3, 58-60.
- 페르난데스 가르시아(M.) 및 알바레스 곤잘레스(M.) Á. (2005). 식품의 생체 아민.
다음을 따르세요:
- 알코올
- 알데하이드
- 에틸 알코올
- 유기화학



