흡열 반응의 예
예 / / November 09, 2023
ㅏ 흡열 반응 이는 열의 형태로 매질로부터 에너지를 흡수하는 반응입니다. 이러한 반응에서 반응물이 생성물로 변환되려면 열을 흡수해야 하며, 이로 인해 생성물은 이를 생성한 반응물보다 더 큰 에너지를 갖게 됩니다. 흡열 반응의 몇 가지 예는 다음과 같습니다. 광합성과 물 전기분해.
- 또한보십시오: 화학 반응
일상 생활에서의 흡열 반응의 예
주요 흡열 반응 중 일부는 다음과 같습니다.
대기 중 오존 생성. 오존은 분자 산소(O2)는 자외선을 흡수하여 분해됩니다. 그러면 산소 원자(O)가 다른 산소 분자(O)와 상호 작용할 수 있습니다.2) 및 오존(O3).

물 전기 분해. 적용하는 과정입니다 전력 물에 수소(H)와 산소(O)라는 두 가지 성분으로 분리합니다.
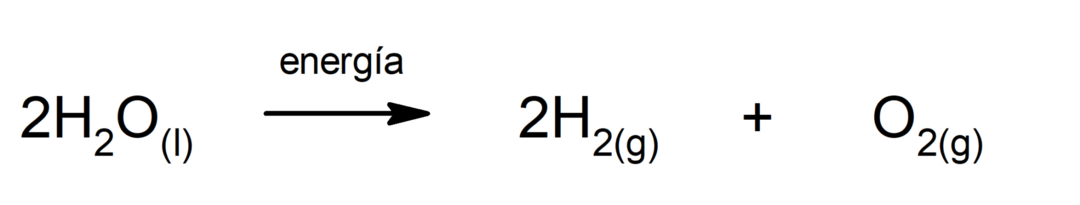
광합성. 흡수하는 화학반응이다. 태양 에너지, 이산화탄소(CO2)가 포도당으로 전환됩니다. 이 반응은 식물의 주요 영양 경로를 구성합니다.
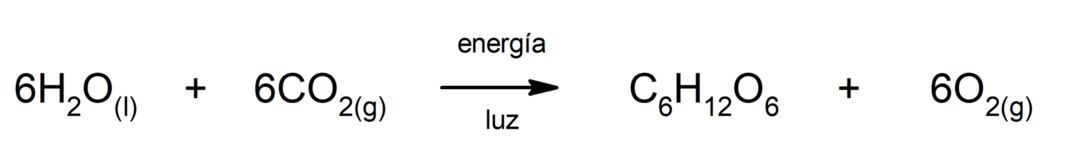
철(II) 황화물 생산. 황과 철 사이의 반응이 일어나려면 열의 형태로 에너지를 공급해야 합니다.
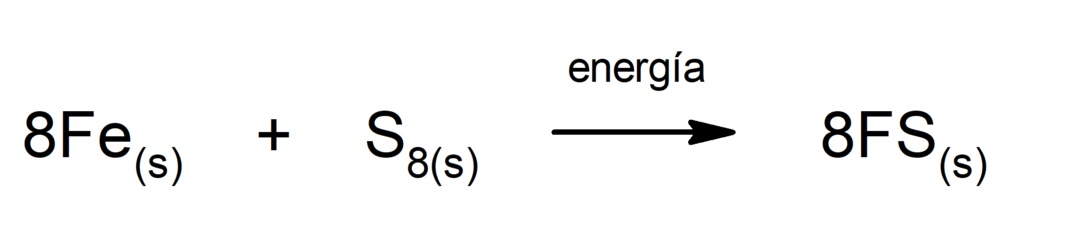
이산화탄소(CO)의 분해2). CO의 분해2 고온에서는 일산화탄소(CO)와 산소(O)를 생성합니다.2).
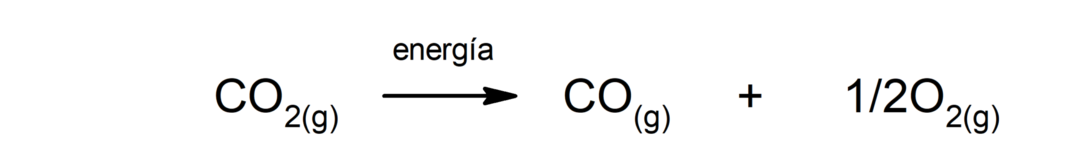
탄산칼슘(CaCO)의 분해3). 탄산칼슘은 열을 흡수하면 분해되어 산화칼슘(CaO)과 이산화탄소(CO)를 생성합니다.2).
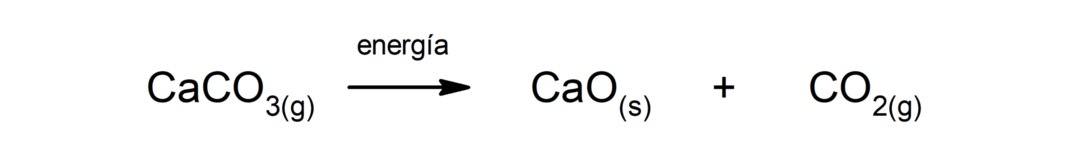
흡열 반응과 발열 반응의 차이점
흡열 반응과 발열 반응의 주요 차이점은 흡열 반응은 열을 흡수하는 반면 발열 반응은 열을 방출한다는 것입니다.
또한, 흡열 반응은 엔탈피의 증가를 특징으로 하는 반면, 발열 반응은 엔탈피의 감소와 관련됩니다.
엔탈피는 화학 반응 중 일정한 압력에서 열 에너지의 흐름을 정의하는 열역학적 양입니다. 문자 H로 표시되며 그 변화는 화학 반응이 흡열인지 발열인지를 정의하는 주요 지표 중 하나입니다.
- 화학 반응의 엔탈피 변화가 0보다 큰 경우(ΔH > 0)는 흡열성이다.
- 화학 반응의 엔탈피 변화가 0보다 작은 경우(ΔH < 0)은 발열성이다.
다음을 따르세요:
- 물리화학적 현상
- 일상생활 속 화학
- 일상생활 속 화학
- 유기 및 무기 화학
참고자료
- 소토-코르도바, S. (2016). 흡열 반응. 기술 저장소 코스타리카 기술 연구소.
- 코로미나스, J. (2017). 일상생활의 화학반응. 증류기, (90), 8-26.
- 산체스, M. 티. M., & 산체스, M. 중. (2002). ESO 학생들의 흡열 반응에 대한 실험적 연구. RSEQ의 화학 연대기, (4), 36-39.