20 Alkanų pavyzdžiai
Įvairios / / July 04, 2021
The alkanai jie yra savotiški angliavandeniliai kuriame kintamas anglies atomų skaičius sujungiami viengubomis jungtimis, pavyzdžiui, skeletu, ir kiekvienas anglies atomas savo ruožtu yra prijungtas prie vandenilio atomų, kuriuos ilgainiui gali pakeisti kiti atomai arba funkcinės grupės. Pavyzdžiui: chloroformas, metanas, oktanas.
molekulinė formulė atviros linijinės grandinės alkanų yra CnH2n + 2, kur C reiškia anglį, H reiškia vandenilį ir n reiškia anglies atomų skaičių. Alkanai yra sotieji angliavandeniliai, o tai reiškia, kad jie neturi dvigubų ar trigubų jungčių. Norėdami juos pavadinti, naudokite priesaga „-Ano“, pavadinęs anglies grandinę naudodamas priešdėlis atitinkantis anglies atomų skaičių (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) ir kt.).
Tai gali jums pasitarnauti:
Alkanų klasifikacija
Alkanuose jie paprastai atpažįstami dvi didelės grupės: atvira grandinė (dar vadinama acikline) ir uždara (arba ciklinė).
Kai atviros grandinės junginiai Jie nepakeičia vandenilių, kurie lydi kiekvieną anglies atomą, jie vadinami linijiniais alkanais: tai paprasčiausi alkanai. Kai jie pakeičia bet kurį iš jų vandenilių viena ar keliomis anglies grandinėmis, jie vadinami šakotaisiais alkanais. Dažniausiai pakaitai yra etilo grupės (CH
3CH2-) ir metilo (CH3-).Savo ruožtu yra junginių, kurių molekulėje yra vienas ciklas (monociklinis), o kiti - su keliais (policikliniais). The cikliniai alkanai Jie gali būti homocikliniai (jie susidaro išskirtinai įsikišus anglies atomams) arba heterocikliniai (kuriuose dalyvauja kiti atomai, pavyzdžiui, deguonis arba siera).
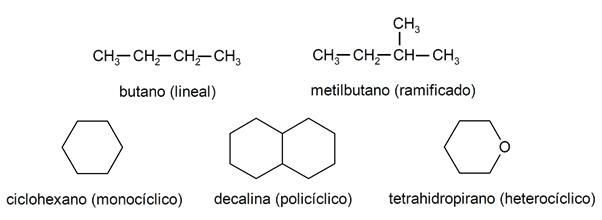
Fizinės alkanų savybės
Apskritai, fizinės savybės alkanų sąlygoja molekulinė masė (savo ruožtu susieta su anglies grandinės ilgiu). Turintys mažiausią anglies kiekį dujinis į temperatūra nuo 5 iki 18 anglies atomų yra skysčiaiir virš šio skaičiaus yra kietas (panašus į vašką).
Būdami mažiau tankūs nei vanduo, jie linkę plaukti ant jo. Paprastai alkanai netirpsta vandenyje ir tirpsta organiniuose tirpikliuose.
Esmė verdamas ir sintezė alkanų priklauso nuo jų molekulinė masė, tai yra, nuo anglies grandinės ilgio, nors jie taip pat daug kartų priklauso nuo atomų erdvinio išsidėstymo. Linijinių ir ciklinių alkanų virimo temperatūra yra aukštesnė nei šakotųjų.
Cheminės alkanų savybės
Alkanams būdinga būtis cheminiai junginiai iš labai prastas reaktyvumas, todėl jie taip pat žinomi kaip „parafinai“ (lotyniškai, parum affinis reiškia „mažas afinitetas“). Jie yra junginiai, kurių aktyvavimo energija yra labai didelė, kai jie dalyvauja cheminės reakcijos. Svarbiausia reakcija, kurią gali sukelti alkanai, yra degimas kuriant deguonį, šilumą, anglies dioksidą ir vandenį.
Alkanai yra svarbios įvairios reakcijos, susijusios su pramoniniai procesai labai svarbu, nes tai yra tradiciškiausias kuras. Jie taip pat atrodo kaip galutiniai biologinių procesų, tokių kaip kai kurių atliekama metanogeninė fermentacija, produktai mikroorganizmai.
Alkanų pavyzdžiai
Keletas alkanų (įskaitant keletą gerai žinomų linijinių ir šakotų) pavyzdžių:
- Chloroformas (išgalvotas trichlormetanas; CHCl3). Šios medžiagos garai anksčiau buvo naudojami kaip anestetikai. Šiuo tikslu jis buvo nutrauktas, nes buvo nustatyta, kad jis pakenkė organai kepenys ar inkstai. Šiandien jis pirmiausia naudojamas kaip tirpiklis arba aušinimo skystis.
- Metanas (CH4). Tai paprasčiausias alkanas iš visų: jį sudaro tik vienas anglies atomas ir keturi vandenilio atomai. Tai dujos, kurios natūraliai susidaro skaidant skirtingus organinius substratus ir yra pagrindinis gamtinių dujų komponentas. Pastaruoju metu jis buvo pripažintas viena iš dujų, kurios labiausiai prisideda prie vadinamojo šiltnamio efekto.
- Oktanas (C8H18). Tai yra aštuonių anglių alkanas ir yra labai svarbus, nes jis lemia galutinę pirminio benzino, kuris yra sumaišyti įvairių angliavandenilių. Ši kokybė matuojama kuro oktaniniu skaičiumi arba oktaniniu skaičiumi, kuris kaip atskaitos taškas yra mažai detonuojantis (100 indeksas) ir labai detonuojantis (indeksas 0).
- Heksanas (C6H14). Tai yra svarbus tirpiklis, jo vengti reikia įkvėpti, nes jis yra labai toksiškas.
- Butanas (C4H10). Kartu su propanu (C.3H8) susidaro vadinamosios suskystintos naftos dujos (SND), kurios susidaro dujų maišeliuose naftos gavybos proceso metu. Šiuo metu skatinamas benzino ar dyzelino pakeitimas SND kaip degalu, nes taip yra ekologiškesnio angliavandenilio (degdamas išskiria tik anglies dvideginį ir vandenį).
- Icosano (C20H42). Tai dvidešimt anglies alkanas (priešdėlis „ico“ reiškia dvidešimt)
- Ciklopropanas (C3H6). Anksčiau jis buvo naudojamas kaip anestetikas
- n-heptanas (C7H16). Tai yra tas, kuris laikomas benzino oktaninės skalės nulio taško atskaitos tašku, kuris būtų mažiausiai pageidautinas, nes jis degina sprogiai. Jis gaunamas iš tam tikrų dervų augalų.
- 3-etil-2,3-dimetilpentanas (C9H20)
- 2-metilbutanas (C5H12)
- 3-chlor-4-n-propilheptanas (C10H21Cl)
- 3,4,6-trimetilheptanas (C10H22)
- 1-brom-2-feniletanas (C8H9Br)
- 3-etil-4-metilheksanas (C9H18)
- 5-izopropil-3-metilnonanas (C13H28)
- Kubietis (C8H8)
- 1-brompropanas (C3H7Br)
- 3-metil-5-n-propiloktanas (C12H26)
- 5-n-butil-4,7-dietildekanas (C18H28)
- 3,3-dimetildekanas (C12H26)

