100 cheminių elementų pavyzdžių
Įvairios / / November 13, 2021
The cheminiai elementai yra tam tikros rūšies reikalai, kurie be procedūros ar cheminė reakcija juos galima sumažinti arba išskaidyti į kitus paprastesnius elementus. Dėl šios priežasties galima sakyti, kad elementas yra viskas reikalas pagaminta atomai tos pačios ir unikalios klasės, tai yra, atomai, kurių atominis skaičius yra vienodas (vienodas protonų skaičius), nors jų atominė masė yra skirtinga. Pavyzdžiui: siera, boras, chromas, alavas.
Pirmąjį cheminio elemento apibrėžimą pristatė Lavoisier adresu Traite Élémentaire de Chimie, 1789 m. Dar XVIII amžiuje Lavoisier paprastas medžiagas suskirstė į keturias grupes:
Periodinė elementų lentelė
Šiandien jie vienas kitą pažįsta 118 cheminių elementų. Jie visi yra surinkti, klasifikuojami ir suskirstyti pagal daugelį jų savybių grafinėje schemoje, vadinamoje periodine elementų lentele, kurią iš pradžių sukūrė rusų chemikas. Dmitrijus Mendelejevas 1869 metais. Periodinę lentelę sudaro 18 grupių (stulpelių) ir 7 periodų (eilučių), kuriuose yra cheminiai elementai.
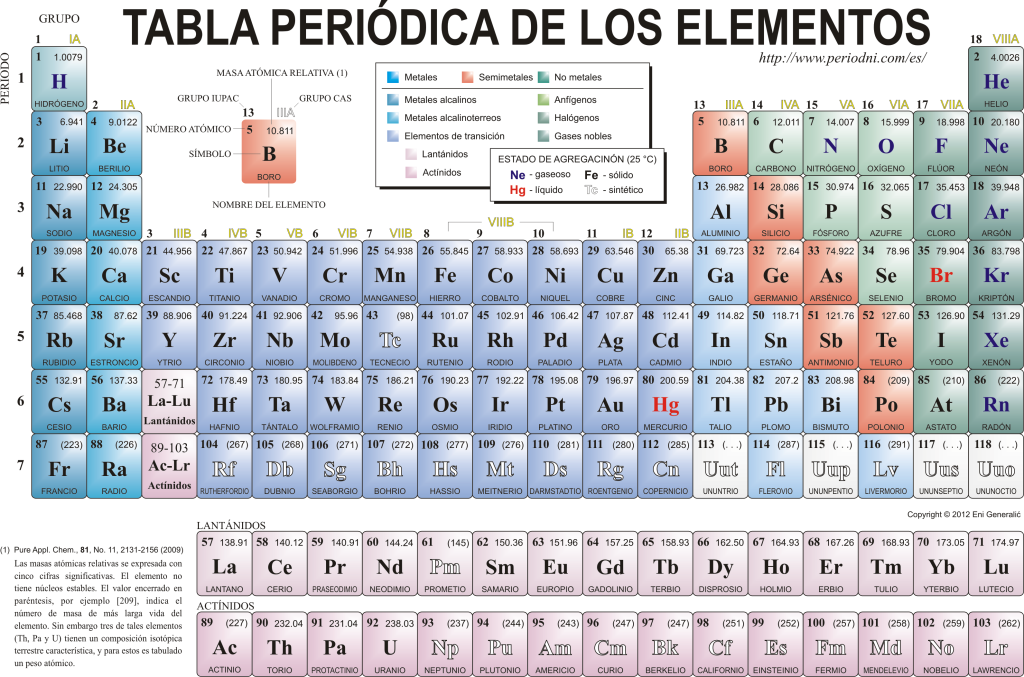
The pagrindinės grupės kurias galima rasti šioje lentelėje:
Šarminiai metalai (1 grupė), šarminių žemių metalai (2 grupė), skandžio šeima, kuri apima žemes ir aktinidus (3 grupė), titano šeima (4 grupė), vanadžio šeima (5 grupė), chromo šeima (6 grupė), mangano šeima (7 grupė), geležies šeima (8 grupė), kobalto šeima (Grupė 9), nikelio šeima (10 grupė), vario šeima (11 grupė), cinko šeima (12 grupė), žemės elementai (13 grupė), karbonidiniai elementai. Anglis, kuri yra gyvybės Žemėje pagrindas (14 grupė), azotą formuojantys elementai (15 grupė), amfigenetiniai elementai, apima deguonį, pagrindinį elementą į kvėpavimas iš gyvi sutvėrimai (16 grupė), halogeninių elementų (17 grupė) ir inertinių dujų (18 grupė).
Daugelis šių elementų turi stabilūs arba radioaktyvūs izotopaity tas pats cheminis elementas, pavyzdžiui, vandenilis (H), gali turėti kelis izotopus (1H, 2H, 3H). Tai reiškia, kad kiekvienas izotopo atomas turi tą patį protonų skaičių (tai reiškia, kad jis priklauso tam pačiam cheminiam elementui) ir skirtingą neutronų skaičių.
Kai kurie izotopai nėra stabilūs (radioaktyvūs), tai yra, suirti per tam tikrą laiką išspinduliuoja tam tikras daleles (neutronus, fotonus, alfa daleles ir kt.) ir sukuria kitus stabilius ar radioaktyvius izotopus. Cheminiai elementai turi tokias savybes kaip taškas verdantis ir kad iš susiliejimas, elektronegatyvumas, tankis ir joninis spindulys, be kita ko. Šios savybės yra svarbios, nes leidžia numatyti jo elgesį, reaktyvumą ir kt.
Kaip periodinėje lentelėje pateikiami elementai?
Kiekvienas cheminis elementas apibūdinamas Periodinė elementų lentelė naudojant tam tikrą simboliką. Visų pirma, kiekvienos dėžutės centre yra universalus simbolis, kurį sudaro vienas arba du raidės (pagal susitarimą, jei yra dvi raidės, pirmoji rašoma didžiosiomis, o kita – mažosiomis).
Viršuje ir kairėje rodomas mažu šriftu su atominis skaičius, kuris nurodo šio elemento protonų kiekį. Po elemento simboliu rodomas jo pavadinimas, o viršuje, kairėje – jo pavadinimas. atominė masė giminaitis. Be to, spalva, kuria pavaizduotas elemento simbolis, reiškia jo sujungimo būseną (pagal kiekvienoje periodinėje lentelėje naudojamą vaizdavimą).
Pateikiami įvairūs elementai atominiai spinduliai kintamieji ir, didėjant protonų skaičiui branduolyje, tuo didesnę trauką branduolys daro elektronams, todėl atomo spindulys linkęs mažėti. Kai atomo spindulys mažas, elektronai, esantys atokiausiame debesies lygyje, labai traukia branduolį, todėl lengvai nepasiduoda. Priešingai atsitinka su elementais, kurių atominis spindulys yra didelis: jie lengvai atsisako savo išorinių elektronų.
Taigi atomo spindulys didėja iš viršaus į apačią, kai pereiname per periodinės lentelės grupes, ir mažėja iš kairės į dešinę, kai pereiname jų laikotarpius.
Cheminių elementų pavyzdžiai
| Cheminis elementas | Simbolis |
| Aktinis | Ak |
| Aliuminis | Į |
| Americium | ESU |
| Stibis | Sb |
| Argonas | Ar |
| Arsenas | Tūzas |
| Astat | At |
| Siera | S |
| Baris | Ba |
| Berilis | Būk |
| Berkelija | Bk |
| Bismutas | Bi |
| Bohrio | Bh |
| Boras | B |
| Bromas | Br |
| kadmis | CD |
| Kalcis | AC |
| Kalifornija | Plg |
| Anglies | C |
| Ceris | EB |
| Cezis | Cs |
| Chloras | Cl |
| Kobaltas | Co |
| Varis | Cu |
| Chrome | Kr |
| Kurijus | Cm |
| Darmstadio | Ds |
| Disprosis | Dy |
| Dubnium | Db |
| Einšteinas | tai yra |
| Erbis | Er |
| Skandis | Sc |
| Skardos | Sn |
| Stroncis | Ponas |
| Europiu | Eu |
| Fermis | Fm |
| Fluoras | F |
| Rungtynės | P |
| Pranciškus | Kun |
| Gadolinis | Gd |
| Galis | Ga |
| germanis | Ge |
| Hafnis | Hf |
| Hassio | Hs |
| Helis | Aš turiu |
| Vandenilis | H |
| Geležis | Tikėjimas |
| Holmium | Ho |
| Indijos | Į |
| Jodas | aš |
| Iridiumas | Eiti |
| Iterbis | Yb |
| Itris | IR |
| Kriptonas | Kr |
| Lantanas | The |
| Lawrencio | Lr |
| Ličio | Li |
| Liutecis | Pirm |
| Magnis | Mg |
| Manganas | Mn |
| Meitnerius | Mt |
| Mendeleviumas | Md |
| Merkurijus | Hg |
| Molibdenas | Mo |
| Neodimis | Na |
| Neoninis | Ne |
| Neptūnas | Np |
| Niobis | Nb |
| Nikelis | Nei |
| Azotas | N |
| Nobelio | Nr |
| Auksas | Au |
| Osmis | Tu |
| Deguonis | ARBA |
| Paladis | P.S |
| sidabras | Ag |
| Platina | Pt |
| Vadovauti | Pb |
| Plutonis | Pu |
| Polonis | Po |
| Kalis | K |
| Prazeodimis | Pr |
| Pažadas | p.m |
| Protaktinis | Pa |
| Radijas | Ra |
| Radonas | Rn |
| Renis | Re |
| Rodis | Rh |
| Rubidis | Rb |
| rutenis | Ru |
| Rutherfordio | Rf |
| Samariumas | Taip |
| Seaborgio | Sg |
| Selenas | Aš žinau |
| Silicis | Taip |
| Natrio | Na |
| Talis | Tl |
| Tantalas | Ta |
| Techneciumas | Tc |
| Telūras | Arbata |
| Terbis | Tb |
| Titanas | Tu |
| Toris | Th |
| Tulis | Tm |
| Kopernikas | Cn |
| Livermorio | Lv |
| Rentgenijus | Rg |
| Ununoktiumas | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uranas | ARBA |
| Vanadis | V |
| Volframas | W |
| Ksenonas | Xe |
| Cinkas | Zn |
| Cirkonis | Zr |

Sekite su:


