Reakcijos greičio ir cheminės pusiausvyros apibrėžimas
Įvairios / / December 14, 2021
Konceptualus apibrėžimas
Reakcija yra cheminėje pusiausvyroje, kai tiesioginės reakcijos greitis yra lygus atvirkštinės reakcijos greičiui.

Chemijos inzinierius
Visi cheminė reakcija turi tam tikrą spontaniškumą jo atžvilgiu Balansas, o norėdami jį ištirti, tai darome per ∆G ženklą, Energija Gibbs free, o tai reiškia, kad pagal šio dydžio vertę galime numatyti, ar reakcija įvyks tam tikra prasme, ar ne.
Gibso laisvosios energijos kitimas paprastai išreiškiamas standartinėmis sąlygomis kaip produktų ir reagentų energijų skirtumas, taip pat standartinėje būsenoje:
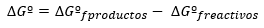
Tuo tarpu, jei reakcija vyksta nestandartinėmis sąlygomis, santykis tarp ∆Gº ir ∆G nustatomas taip: išraiška:
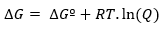
Kur Q yra reakcijos koeficientas.
Norėdami suprasti, ką reiškia reakcijos greitis ir cheminę pusiausvyrą turime ištirti ∆G ženklą:
Jei ∆G yra neigiamas, tai reiškia, kad reakcija yra spontaniška (vyksta) tiesiogine prasme.
Jei ∆G teigiamas, tai reiškia, kad reakcija nėra spontaniška (nevyksta) tiesiogine prasme.
Tuo tarpu, jei ∆G = 0, pokyčių nebus, nes sistema yra pusiausvyroje ir, kaip jau minėta, greitis Tiesioginės reakcijos greitis yra lygus netiesioginės reakcijos greičiui. Tai reiškia, kad reakcijos koeficientas Q yra lygus pusiausvyros konstantai K, todėl nėra tendencijos teikti pirmenybę konkrečiai reakcijos krypčiai.
Kadangi Q apibrėžiamas taip:
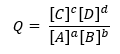
Dėl bendros reakcijos:
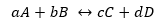
Nors K įgauna tą pačią formą, bet su pusiausvyros koncentracija.
Jei grįšime prie atvejo, kai ∆G yra neigiamas, tai reiškia, kad reakcijos koeficientas Q yra mažesnis už K (konstanta pusiausvyra), reiškia, kad produkto koncentracija yra mažesnė, nei turėtų būti, jei reakcija vyktų Balansas. Todėl spontaniškumo požiūriu jis tampa spontanišku tiesiogine prasme.
Tuo tarpu, jei ∆G teigiamas, bus daugiau produktų, viršijančių tuos, kurie turėtų egzistuoti, jei sistema būtų pusiausvyroje, o Q didesnis nei K. Todėl reakcija yra spontaniška atvirkštine kryptimi.
Reikėtų pažymėti, kad griežtas Q ir K apibrėžimas pateikiamas atsižvelgiant į produktų ir reagentų aktyvumą, apibrėžiant aktyvumą koncentracijos arba slėgių požiūriu:
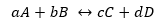
O gerai:
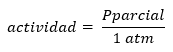
Iš to matyti, kad tiek Q, tiek K yra bedimensijos ir gali būti padidintos tiek koncentracijomis, tiek daliniu slėgiu.
Kai produktų ir reagentų koncentracija arba dalinis slėgis laikui bėgant išlieka pastovus, susidaro tokia situacija cheminė pusiausvyra tiek, kiek pasiekiama dinaminės pusiausvyros padėtis dėl tiesioginės ir atvirkštinės reakcijos su identiški. Svarbu pabrėžti pusiausvyros dinamiškumą, jų susidarymo greitį ir suvartoti produktai ir reagentai yra vienodi, todėl koncentracijos ar dalinis slėgis nėra tai skiriasi.
Jei sąlyga nutolsta nuo pusiausvyros situacijos, tam tikros rūšys vyraus prieš kitas ir iš ten atsiranda išraiška, siejanti tiesioginės ir atvirkštinės reakcijos greitį Kc:
Tarkime, kad reakcija matoma aukščiau:
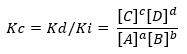
Kur Kd ir Ki yra reakcijos greičio konstantos atitinkamai pirmyn arba atgal.
Vėlgi, jei Kc> 1, tai reiškia, kad Ki yra mažesnis nei Kd, todėl produktai yra labai paverčiami reagentais. Šiuo atveju pusiausvyra perkeliama į produktus.
Atvirkščiai atsitinka, jei Kc <1, o tai reiškia, kad tiesioginės reakcijos greitis yra mažesnis už netiesioginės reakcijos greitį ir yra mažas vartojimo reagentų pusiausvyra pasislenka link reagentų. Tuo tarpu, jei Kc = 1, greičiai yra vienodi ir sistema yra pusiausvyroje. Svarbu apibrėžti du klausimus: pirma, šios konstantos reikšmė priklauso tik nuo temperatūros ir, savo ruožtu, skiriasi pagal dydį, naudojamą produktų ir reagentų koncentracijai arba slėgiui išreikšti. Galiausiai, įstatymas Cheminė pusiausvyra prisitaiko prie praskiestų tirpalų ar dujų esant žemam slėgiui.
Reakcijos greičio ir cheminės pusiausvyros temos