Molekulinės geometrijos apibrėžimas
Įvairios / / January 11, 2022
Konceptualus apibrėžimas
Tai molekulės struktūra, kuri nulemia ją sudarančių atomų trimatį išsidėstymą erdvėje.

Chemijos inzinierius
Šiuo metu molekulinės geometrijos apibrėžiamos remiantis Teorija Valensijos sluoksnio elektroninių porų atstūmimas (TRPECV). Ši teorija leidžia numatyti elgesį cheminis medžiagų (ypač kovalentinių) ir padeda suprasti paskirstymas elektronika, vedanti į geometrija iš molekulė. Tai savo ruožtu leidžia suprasti daugelį savybių, kurias įgyja medžiagos.
Ši teorija remiasi keletu pagrindinių ramsčių, kuriuos apžvelgsime ir bandysime juos suprasti taikymas praktika. Visų pirma, surišti ir nesurišti (valentingi) elektronai laikomi elektronų jūra, kuri turi to paties tipo krūvį, jie atstumia vienas kitą, todėl visada bus kuo toliau nuo centrinio atomo molekulė.
Antra, ši elektronų „jūra“ arba „elektroninis debesis“ sudaro didelio elektronų tankio sritis, kurios yra sudarytos ryšiuose, kur elektronai yra bendri, arba elektronų porose, kurių nėra. Savo ruožtu susidarančios jungtys gali būti viengubos, dvigubos ar net trigubos.
Galiausiai, už nuspręsti molekulinė geometrija, labai naudinga turėti Lewis struktūrą, kurioje bus skaičiuojamas elektronų tankis aplink centrinį atomą ir tai duos indikacija nuo jos geometrijos pavadinimo ir formos, kurią molekulė įgauna trimačiais.
Reikėtų pažymėti, kad šie tankiai bus išdėstyti kuo toliau vienas nuo kito, kad būtų stabiliausia struktūra ir kur būtų mažiau atstūmimo. Taip pirmiausia identifikuojama elektroninė geometrija, o paskui – molekulinė geometrija.
Šeši tankio lygiai
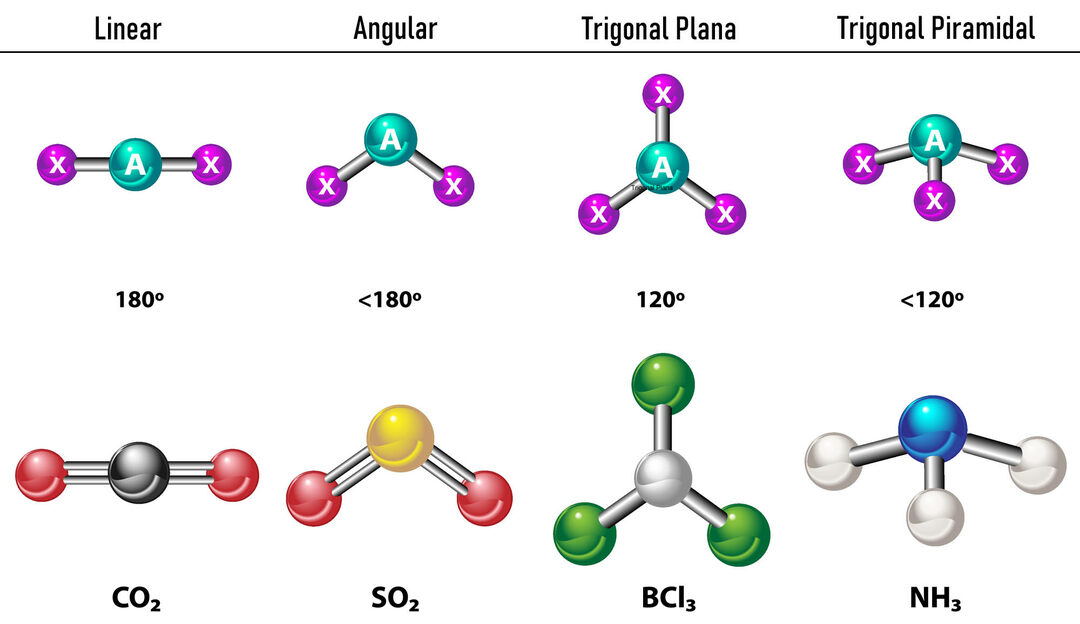
Tuo atveju, kai aplink centrinį atomą yra du elektronų tankiai, ryšiai bus kuo toliau vienas nuo kito tarp jų, ty 180º vienas nuo kito, todėl jų elektroninė geometrija yra tiesinė, o molekuliniu požiūriu ji taip pat yra linijinė.
Tuo atveju, kai aplink centrinį atomą yra trys elektronų tankiai, yra dvi galimybės: trys ryšiai arba du ryšiai ir viena nesusijusi pora. Jei yra trys ryšiai, elektroninė geometrija yra Trikampis butas, su 120º kampu tarp jungčių ir molekulinė geometrija turi tą patį pavadinimą. Dabar, jei yra nesusijusi pora, jie atstumia vienas kitą daugiau intensyvumo kad surišti krūviai todėl linkę suspausti ryšio kampus. Kampas tarp laisvosios poros ir kiekvienos jungties yra 120º, o elektroninė geometrija yra trigonalinė plokštuma, o molekulinė geometrija yra kampinė.
Tuo atveju, kai aplink centrinį atomą yra keturi elektronų tankiai, elektroninė geometrija yra tetraedrinė. Jei visos keturios elektronų poros yra sujungtos, jų molekulinė geometrija pagal pavadinimą sutampa su elektronine geometrija, o ryšio kampas yra 109,5º. Dabar, jei viena iš porų yra laisva, ryšio kampas sumažėja (107º) ir molekulinė geometrija yra tipo Trigonalinė piramidė. Galiausiai, jei dvi yra laisvos poros ir dvi yra sujungtos, ryšio kampas yra 104,5º, o molekulinė geometrija vadinama Kampinis.
Kai elektronų tankis aplink centrinį atomą yra penki, tai vadinama a Trigonalinė bipiramidė jo elektroninė geometrija. Jei visos apkrovos yra susietos, tarp pusiaujo esančių jungčių yra 120ºC kampai, o tarp ašinių ir pusiaujo – 90º. Dabar molekulinė geometrija taip pat vadinama trigonine bipiramide, o turint keturias susietas poras ir vieną laisvą porą, molekulinė geometrija yra iškraipyta ir susidaro gerai žinoma "rokeris“, yra pavadinimas, kurį ji įgyja Iškreiptas tetraedras. Tuo tarpu, jei dvi iš penkių elektronų porų yra laisvos, o trys iš jų yra sujungtos, ji turi „T“ formos geometriją ir jos pavadinimas yra būtent dėl jo struktūros. Galiausiai, jei tai yra atvirkščiai, trys laisvos poros ir du susieti krūviai, molekulinė geometrija yra tiesinė.
Galiausiai aplink centrinį atomą yra šeši elektronų tankiai ir susidaro oktaedras, todėl jo pavadinimas elektroninėje geometrijoje. Panašiai molekulinė geometrija įvardijama, jei visos jos poros yra susietos. Jei turite penkias susietas poras ir vieną laisvą porą, molekulinė geometrija yra kvadratinės bazės piramidė. Jei turite keturias sujungtas poras ir dvi laisvas poras, molekulinė geometrija yra tokia Kvadratinis butas.
Paveikslas: Saldi gamta
Molekulinės geometrijos temos


