30 alkoholinių gėrimų pavyzdžių
Pavyzdžių / / November 06, 2023
The alkoholiai yra organiniai cheminiai junginiai kurių struktūroje yra hidroksilo funkcinė grupė (-OH), prijungta prie anglies (-C). Grupė (-C – OH) vadinama „karbinoliu“. Kai kurie alkoholio pavyzdžiai: metanolis, etanolis ir 1-propanolis.
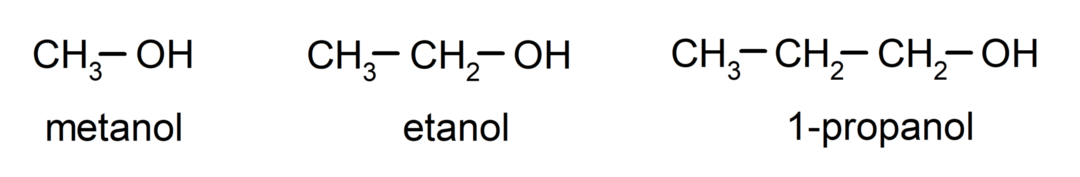
Alkoholiai yra cheminiai junginiai, kurie kasdieniame gyvenime naudojami įvairiai, nes turi antibakterinių ir antiseptinių savybių. Kita vertus, nekontroliuojamai praryti jie gali būti pavojingi žmonių sveikatai.
Taip pat ne visus alkoholius žmonės gali nuryti.
- Taip pat žiūrėkite: Aminai ir ketonai
Alkoholio rūšys
Priklausomai nuo anglies atomų, prie kurių yra prijungtas anglies atomas, turintis hidroksilo grupę, skaičių, alkoholis gali būti:
- Pirminis alkoholis. Anglies atomas, prie kurio prijungta hidroksilo grupė, taip pat yra prijungtas prie vieno anglies atomo. Pavyzdžiui:
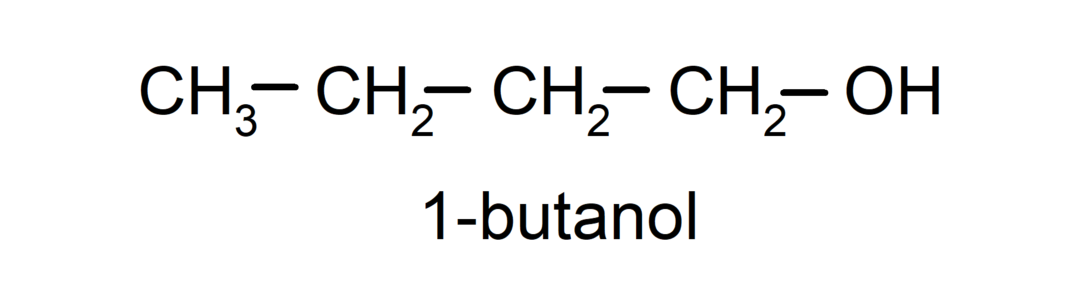
- Antrinis alkoholis. Anglies atomas, prie kurio prijungta hidroksilo grupė, taip pat yra prijungtas prie dviejų kitų anglies atomų. Pavyzdžiui:
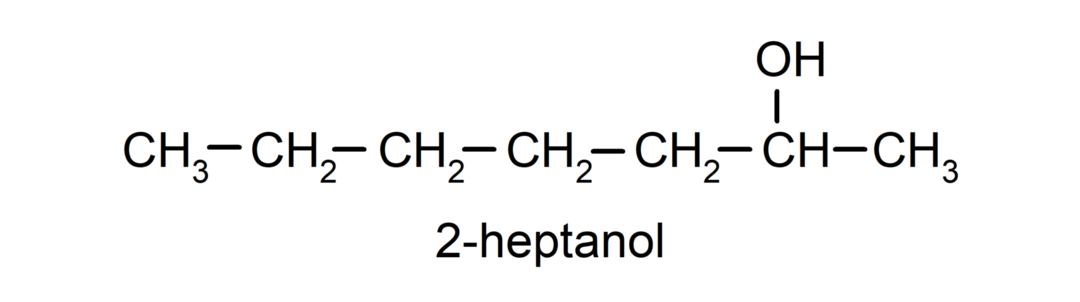
- Tretinis alkoholis. Anglies atomas, prie kurio prijungta hidroksilo grupė, taip pat yra prijungtas prie trijų anglies atomų. Pavyzdžiui:
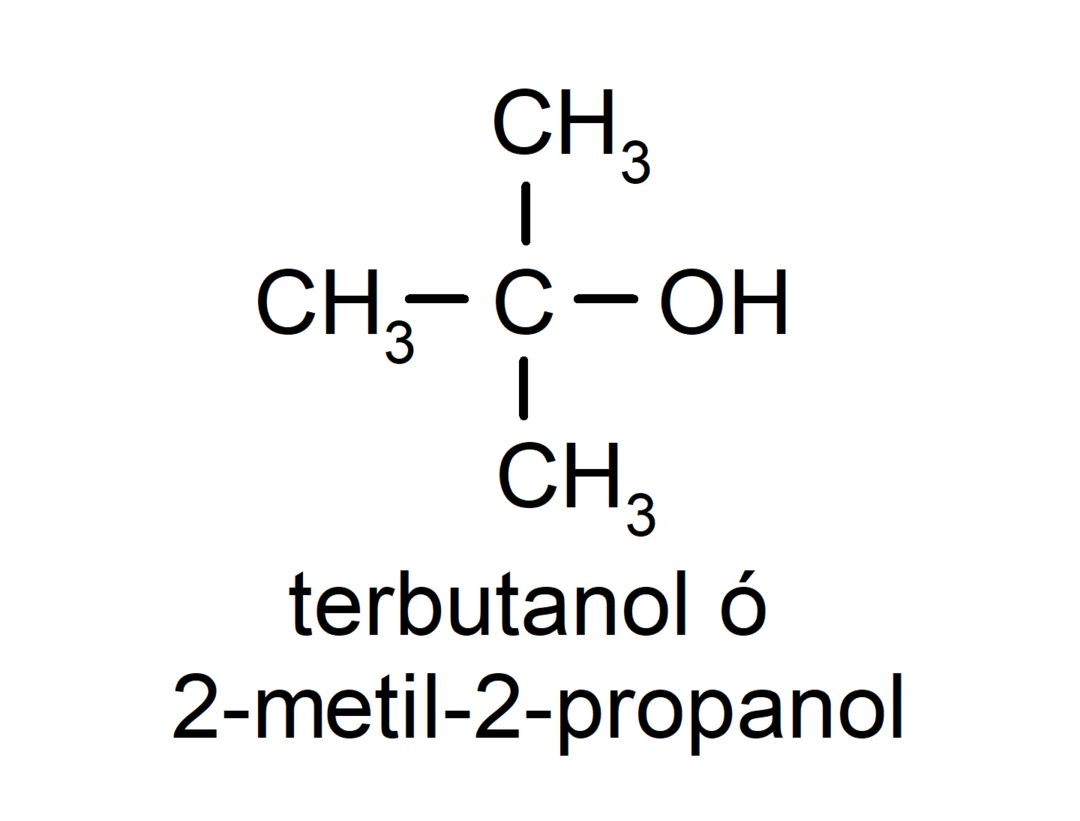
Priklausomai nuo jame esančių hidroksilo grupių skaičiaus, alkoholis gali būti:
- Diol. Jo struktūroje yra dvi hidroksilo grupės. Pavyzdžiui:
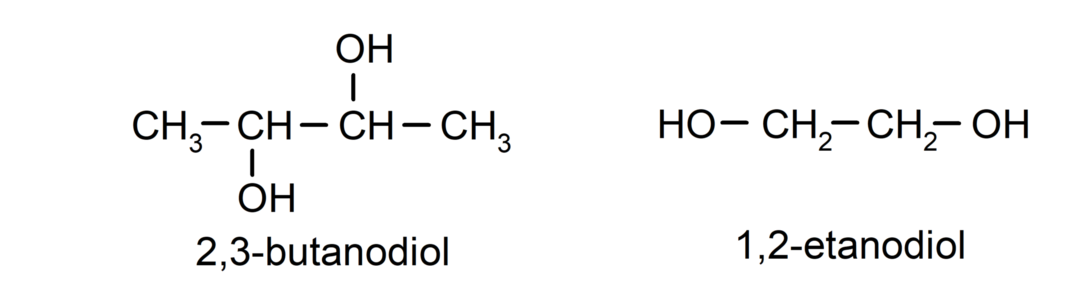
- Triol. Jo struktūroje yra trys hidroksilo grupės. Pavyzdžiui:
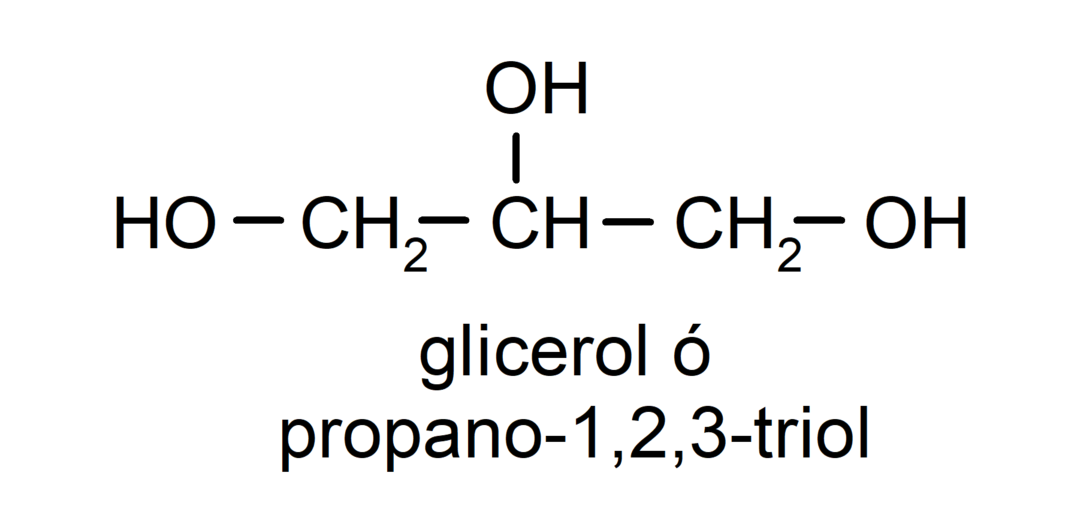
- Polialkoholis. Jo struktūroje yra daug hidroksilo grupių. Pavyzdžiui:
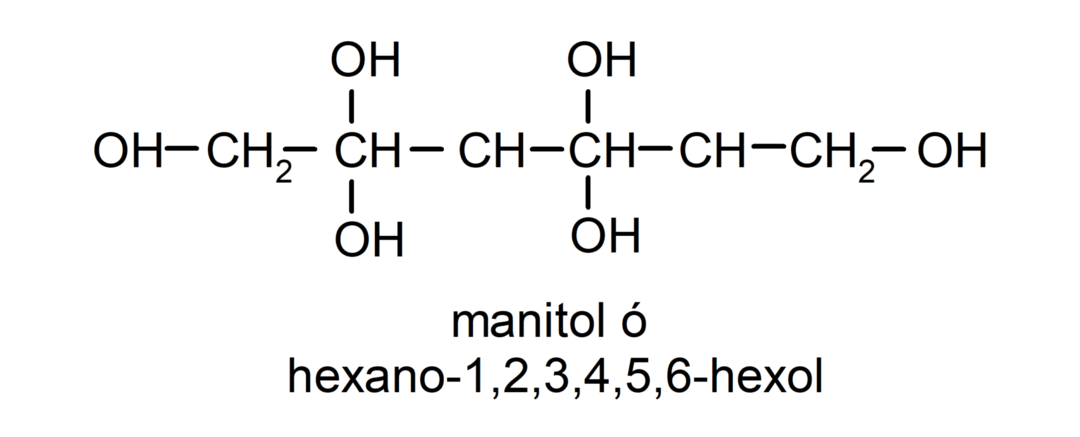
Fizinės alkoholių savybės
Kai kurios fizinės alkoholio savybės yra šios:
- Virimo taškas. Virimo temperatūra alkoholiuose yra gana aukšta dėl hidroksilo grupės, kuri leidžia susidaryti vandenilio jungtims. Be to, kuo daugiau hidroksilo funkcinių grupių yra anglies grandinėje, tuo didesnė Virimo taškas alkoholių.
- Poliškumas. Alkoholiai yra gana poliniai junginiai.
- Tirpumas. Mažos molekulinės masės alkoholiai tirpsta vandenyje. Kita vertus, kuo didesnė alkoholių anglies grandinė, tuo mažesnis jų tirpumas vandenyje. Be to, kuo daugiau alkoholių turi hidroksilo grupių, tuo didesnis jų tirpumas vandenyje.
- Sumavimo būsena. Dauguma alkoholių kambario temperatūroje (25ºC) yra skysti ir turi būdingą kvapą.
Cheminės alkoholių savybės
Kai kurios cheminės alkoholio savybės yra šios:
- Alkoholiai elgiasi kaip rūgštys ir šarmai.. Jų, kaip rūgščių, elgesys gali būti stebimas reakcijose su aktyviais metalais, išskiriant vandenilio dujas ir formuojant alkoksidus.

Jų, kaip bazių, elgesį galima pastebėti tokiose reakcijose kaip metanolio reakcija su vandenilio bromidu, kad susidarytų metiloksonio bromidas.
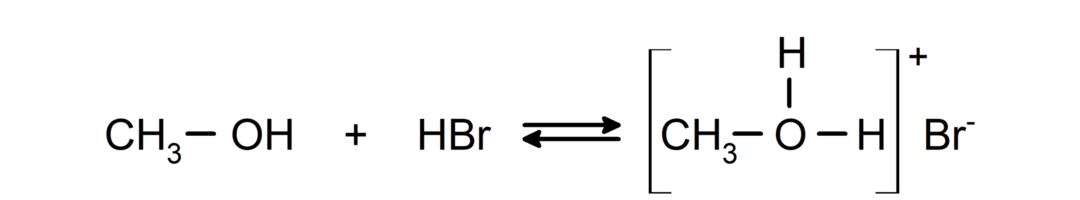
- Alkoholiuose vyksta halogeninimo reakcijos. Jie reaguoja su vandenilio halogenidais, sudarydami alkilhalogenidus.
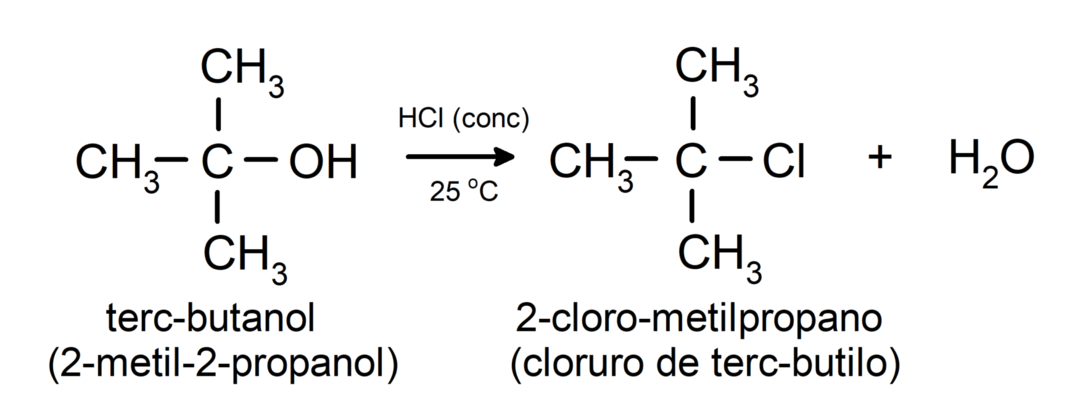
-
Alkoholiuose vyksta oksidacijos reakcijos kai jie reaguoja su tam tikrais oksiduojančiais junginiais. Oksidacijos reakcijų produktai priklauso nuo reaguojančio alkoholio tipo, tai yra, ar jis yra pirminis, antrinis ar tretinis.
Pirminio alkoholio oksidacija į aldehidą arba karboksirūgštį.
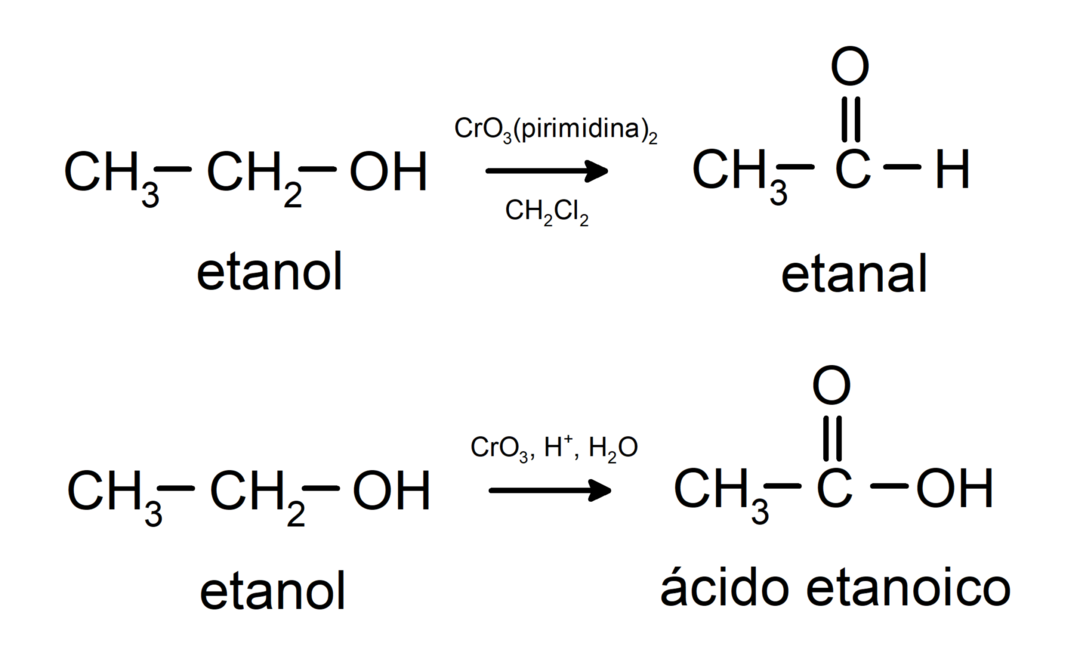
Antrinio alkoholio oksidacija, kad susidarytų ketonas.
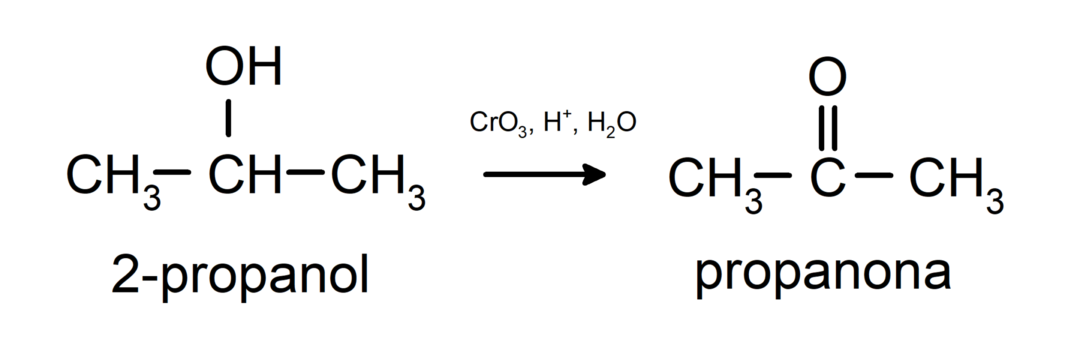
Tretiniai alkoholiai nesioksiduoja su įprastais oksidatoriais. Su labai stipriais oksidatoriais jie gali virsti alkenais, kurie vėliau gali būti oksiduojami.
Alkoholiai, turintys dvi hidroksilo grupes, esančias gretimose anglies atomuose, oksiduojami švino tetraacetatu, kad susidarytų du ketonai.
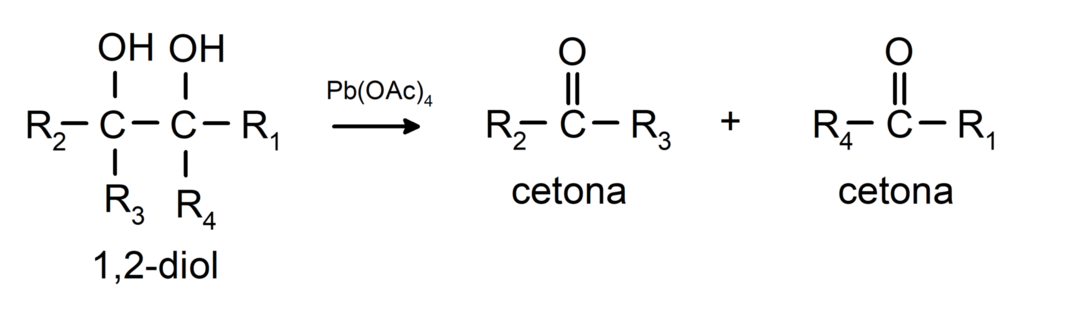
- Alkoholiuose vyksta dehidrinimo reakcijos. Šios reakcijos vyksta tik su pirminiais ir antriniais alkoholiais, kurie veikiant aukštai temperatūrai ir esant katalizatoriams išskiria vandenilius.
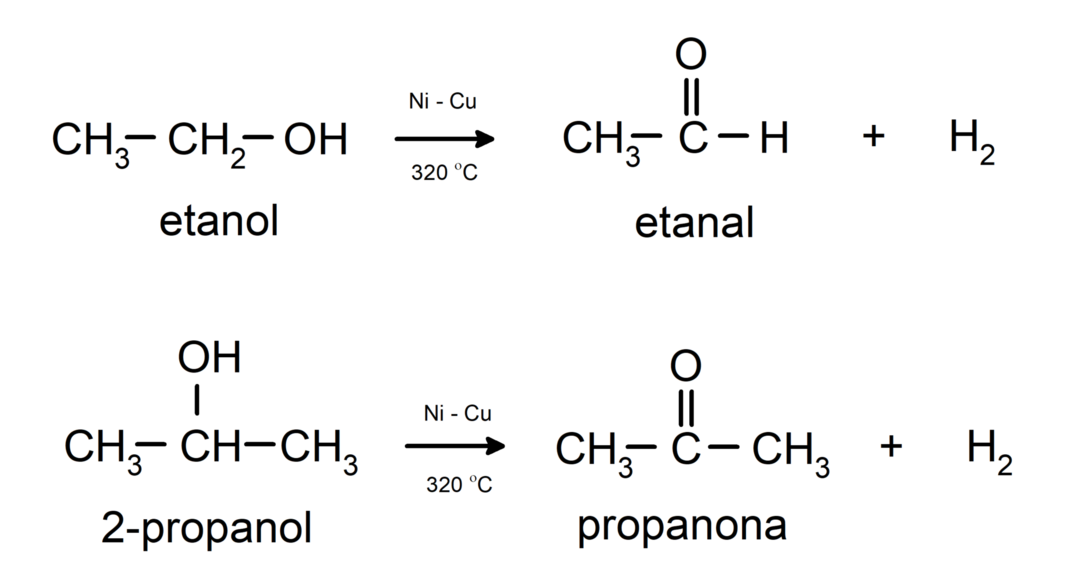
- Alkoholiai patiria dehidratacijos reakcijas. Alkoholiai dehidratuojasi ir susidaro atitinkami alkenai. Ši reakcija vyksta esant rūgščiai ir vidutinei temperatūrai.
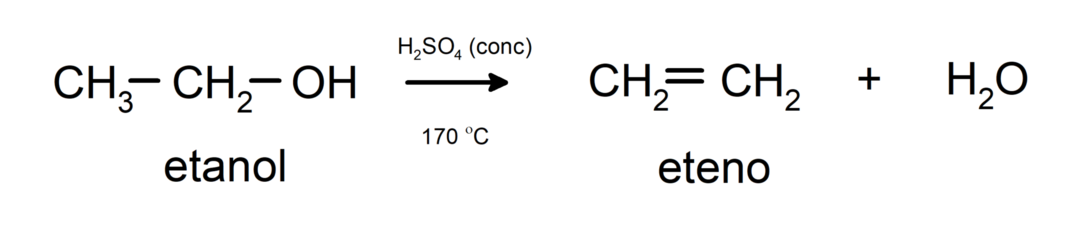
Alkoholio nomenklatūra
Pagal IUPAC (Tarptautinės grynosios ir taikomosios chemijos sąjungos) nustatytą nomenklatūrą alkoholiai pavadinami pagal šias taisykles:
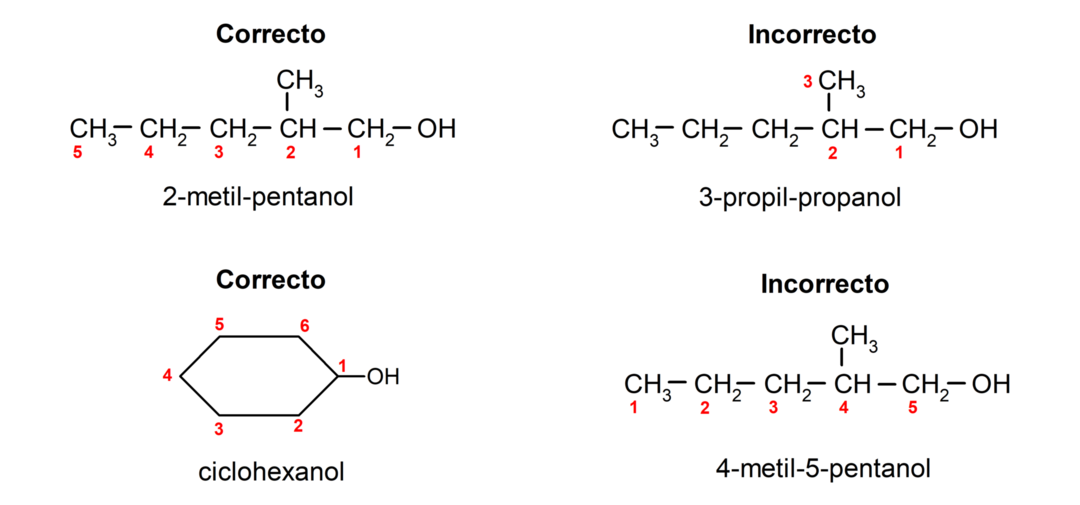
- Hidroksilo grupės padėtis parenkama atsižvelgiant į tai, kad ji anglies grandinėje užima mažiausią įmanomą skaičių. Jei alkoholio struktūra yra ciklinė, atsižvelgiama į 1 vietą ant anglies, prie kurios yra prijungta hidroksilo grupė, ir jai pavadinti naudojamas priešdėlis ciklo-.
- Alkoholio pavadinimas rašomas naudojant priešdėlius, nurodančius atomų skaičių anglies grandinėje, be to, dedama priesaga -ol.
- Jei alkoholio struktūra turi šakas, pagrindine anglies grandine pasirenkama ilgiausia grandinė, kurioje yra ir hidroksilo grupė.
Pagal tradicinę nomenklatūrą alkoholiai įvardijami rašant žodį „alkoholis“, o tada parašant alkoholio pavadinimą. alkanas, atitinkantis anglies grandinę, bet vietoj to, kad būtų naudojama alkano -aninė galūnė, galūnė - iliška.
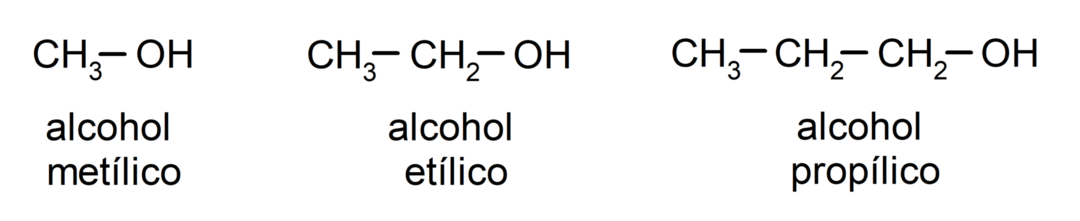
Alkoholio pavyzdžiai
- metanolis
- etanolis
- 1-propanolis
- 2-propanolis
- 1-butanolis
- 3-etilheksan-2-olis
- glicerolis
- fenolis
- 2-metil-2-butanolis
- 1,2-etandiolis
- 1,5-heptadien-3-olis
- 3-metil-2-butanolis
- benzilmetanolis
- 3-pentanolis
- 2-metilfenolis
- 1,2-dihidroksifenolis
- cikloheaksnolis
- 1-feniletanolis


Alkoholių naudojimas
Dažniausiai naudojami alkoholiai:
- Jie naudojami kaip dezinfekavimo ir antiseptikai, nes stabdo kai kurių augimą mikroorganizmai arba juos sunaikinti. Šiuo tikslu dažniausiai naudojamas etanolis ir izopropilo alkoholis.
- Jie naudojami įvairių sintezei cheminiai junginiai. Pavyzdžiui, metanaliui (formaldehidui) gauti naudojamas metanolis.
- Jie naudojami antifrizo gamybai. Metanolis yra vienas iš dažniausiai šiam tikslui naudojamų.
- Jie naudojami kaip tirpikliai farmacijos pramonėje. Etanolis yra vienas iš dažniausiai naudojamų šia prasme.
- Jie naudojami kaip lakų, dažų ir rašalo tirpikliai. Šiuo tikslu plačiai naudojamas metanolis.
- Jie naudojami kaip kuras ir yra svarbi tendencija iš dalies pakeisti jų naudojimą iškastinis kuras naudojant bioetanolinį kurą.
- Jie naudojami dervoms gaminti. Šia prasme naudojamas fenolis.
Alkoholio vartojimo pavojai
Nors alkoholio vartojimas šiandien yra socialiai priimtas, piktnaudžiavimas šia medžiaga sukelia priklausomybę ir priklausomybę.
Etanolis yra alkoholiniuose gėrimuose esantis alkoholis, kurio perteklius paveikia pažintinius gebėjimus, gali sukelti širdies ir kraujagyslių ligas, kepenų cirozę ir vėžys.
Be to, pasiekus apsvaigimo nuo alkoholio laipsnį, tai yra girtumo būseną, jei dozė per didelis alkoholio kiekis, gali ištikti alkoholinė koma, kuri gali sukelti kvėpavimo paralyžių ir net mirtį. mirtis.
Nuorodos
- T. KAM. Geismanas. (1974) „Organinės chemijos principai“ antrasis leidimas. Redakcija Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. ir Valdezas-Montero, C. (2017). Alkoholio vartojimas kaip visuomenės sveikatos problema. Ra Ximhai, 13(2), 13-24.
- Morrisonas, R. T. ir Boydas, R. N. (1998). Organinė chemija. Pearsono išsilavinimas.
- Weiningeris, S. J. ir Stermitzas, F. R. (1988). Organinė chemija. Aš apsiverčiau.
Sekite su:
- Etilo alkoholis
- Degalai
- organinė chemija
