30 dvejetainių pardavimų pavyzdžių
Pavyzdžių / / November 09, 2023
The dvejetainės druskos (neutralios druskos) susidaro derinant metalą ir nemetalą. Yra cheminiai junginiai sudarytas tik iš dviejų cheminiai elementai. Pavyzdžiui: natrio chloridas (NaCl) ir kalio bromidas (KBr).
- Taip pat žiūrėkite: Metalai ir nemetalai
Dvejetainių druskų pavyzdžiai
- Natrio chloridas (NaCl)
- Geležies (II) chloridas (FeCl2)
- Geležies (III) chloridas (FeCl3)
- Kobalto (II) sulfidas (CoS)
- Kobalto (III) sulfidas (Co2Taip3)
- Švino (II) sulfidas (PbS)
- Švino (IV) sulfidas (PbS2)
- Kalcio chloridas (CaCl2)
- Natrio fluoridas (NaF)
- Ličio chloridas (LiCl)
- Stroncio chloridas (SrCl2)
- Bario chloridas (BaCl2)
- Aliuminio chloridas (AlCl3)
- Magnio sulfidas (MgS)
- Rubidžio chloridas (RbCl)
- Kalcio bromidas (CaBr2)
- Kalio sulfidas (K2S)
- Magnio bromidas (MgBr2)
- Cinko sulfidas (Zn2S)
- Ličio bromidas (LiBr)
- Nikelio chloridas (NiCl2)
- Urano(III) chloridas (UCl3)
- Sidabro bromidas (AgBr)
- Sidabro jodidas (AgI)
- Kalio bromidas (KBr)
Dvejetainių druskų nomenklatūra
Pagal Tradicinę nomenklatūrą, dvinarės druskos įvardijamos rašant nemetalinio elemento pavadinimą su galūne -ide. Kita vertus, metalinio elemento pavadinimas rašomas pagal jo oksidacijos būseną:
- Žemiausia oksidacijos būsena rašoma su galūne -oso. Pavyzdžiui: geležies chloridas (FeCl2), kur geležies oksidacijos laipsnis yra 2+.
- Aukščiausiai oksidacijos būsenai rašoma su galūne -ico. Pavyzdžiui: geležies chloridas (FeCl3), kur geležies oksidacijos laipsnis yra 3+.
Pagal sisteminę nomenklatūrą, dvejetainės druskos įvardijamos rašant nemetalinio elemento pavadinimą su priešdėliu, nurodančiu jo kiekį. atomai šio junginio elemento. Be to, nemetalinio elemento pavadinime dedama galūnė -uro. Tada įdedamas metalinio elemento pavadinimas. Pavyzdžiui: magnio dichloridas (MgCl2) ir geležies trichloridas (FeCl3).
Pagal Stock nomenklatūrą, dvejetainės druskos įvardijamos rašant nemetalinio elemento pavadinimą su galūne -ide. Tada įdedamas metalinio elemento pavadinimas, po kurio rašoma jo oksidacijos būsena, parašyta romėniškais skaitmenimis ir skliausteliuose. Pavyzdžiui: geležies (II) chloridas (FeCl2) ir kobalto (III) sulfidas (Co2Taip3).
Dvejetainių druskų taikymas
- Jie naudojami kaip šaltnešiai maisto ir farmacijos pramonėje. Pavyzdžiui: kalcio chloridas (CaCl2).
- Jie naudojami metaliniams paviršiams apdoroti nuo korozijos. Pavyzdžiui: natrio fluoridas (NaF).
- Jie naudojami drėgmei reguliuoti popieriaus ir statybos pramonėje. Pavyzdžiui: kalcio chloridas (CaCl2).
- Jie naudojami stiklo pramonėje priemaišoms pašalinti. Pavyzdžiui: silicio tetrachloridas (SiCl4).
- Jie naudojami kaip maisto ruošimo ingredientai. Pavyzdžiui: natrio chloridas (NaCl).
Dvejetainių druskų fizinės savybės
- Jie turi aukštą lydymosi temperatūrą, nes yra sudaryti iš joninės jungtys.
- Ištirpę arba ištirpę jie praleidžia elektros srovę.
- Labiausiai paplitusios druskos yra mažo kietumo.
- Jie nėra suspaudžiami.
- Dauguma gali ištirpti vandenyje.
Kaip gaunamos dvejetainės druskos?
Dvejetaines druskas galima gauti per kai kurias iš šių cheminių reakcijų:
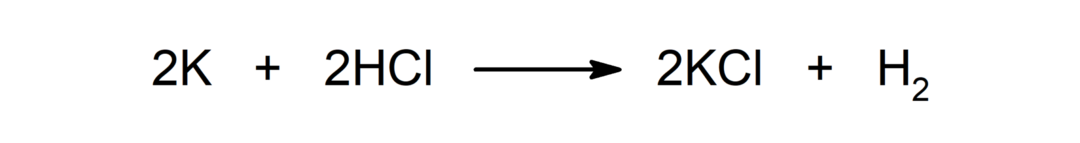
Reakcija tarp metalo ir nemetalo. Pavyzdžiui: reakcija tarp natrio (Na) ir dichlorido (Cl2) gamina natrio chloridą (NaCl).
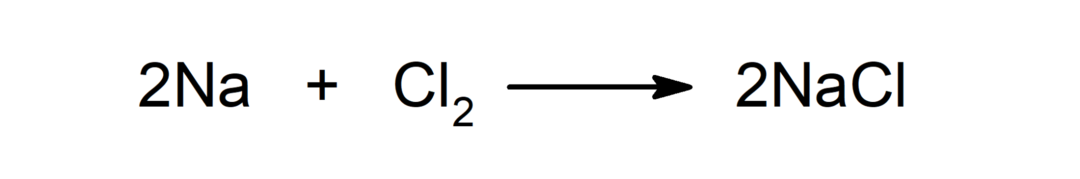
Reakcija tarp metalo ir rūgšties. Pavyzdžiui: Reakcijoje tarp kalio (K) ir druskos rūgšties (HCl) susidaro kalio chloridas (KCl) ir dvivandenis (H).2).
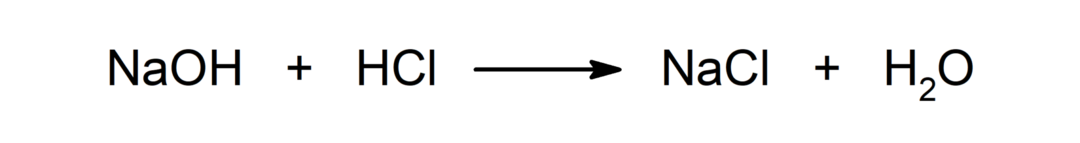
Reakcija tarp rūgšties ir bazės. Pavyzdžiui: Reakcijoje tarp druskos rūgšties (HCl) ir natrio hidroksido (NaOH) susidaro natrio chloridas (NaCl) ir vanduo (H2ARBA).
Sekite su:
- oksidruskos
- neutralios druskos
- rūgščių druskos
Nuorodos
- Cerón Villalba, A., Novoa Ramírez, C. S. ir Alpizar Juárez, E. (2020). 1 nomenklatūros vaizdo įrašas: dvejetainės druskos ir cheminė reakcija.
- Acurio Arias, M. V. ir Delgado Méndezas, M. IR. (2022). Žaidimu pagrįstas mokymosi vadovas „dvejetainiams junginiams“ vidurinės mokyklos chemijoje „Herlindos Toral“ ugdymo skyriuje (bakalauro baigiamasis darbas, Nacionalinis edukologijos universitetas).
- Kabrera, M. J. H. (2005). Dvejetainių ir trijų komponentų junginių elektroninių ir struktūrinių savybių pirmųjų principų tyrimas (Daktaro disertacija, La Lagunos universitetas).