Cheminių elementų pavyzdys
Chemija / / July 04, 2021
Cheminis elementas tai gryna medžiaga, sudaryta iš to paties tipo atomų, savo ruožtu susiformavo protonu ir neutronu branduolyjeir kiekis elektronai savo orbitose. Kai kurie randami natūraliai, kiti - formuojant junginio molekules, o kiti buvo sukurti atliekant laboratorines procedūras. Visi cheminiai elementai sudaro visos visatos materiją ir palaiko žmogaus kūno egzistavimą ir funkcionavimą.
Kiekvienas elementas turi savybių ir elgsenos, leidžiančių jį atskirti ir padaryti unikalų, bet tuo pačiu metu ji pateikia panašumų su elementų grupe pasireiškime, kurį jie turi visata. Dėl šios priežasties yra periodinė cheminių elementų lentelė, kurioje nagrinėjami šie panašumai, siekiant nuosekliai sugrupuoti elementus ir palengvinti jų savybių tyrimą.
Elemento atominis skaičius
Atomas nešioja branduolyje daug protonų, lydimų tiek pat neutronų. Į šį skaičių Jis vadinamas atominiu skaičiumi, atstovaujama kaip Z akademiniais tikslais ir literatūroje. Kiekvienam elementui šis skaičius bus unikalus. Nėra dviejų elementų su tuo pačiu atominiu skaičiumi. Periodinė lentelė taip pat sutelkia dėmesį į šį jų užsakymo kriterijų.
Elemento simbolis
Alchemijos laikais, apimančiais maždaug 400–1000 m. Po Kristaus. C., alchemikai užfiksavo savo eksperimentus, elementams priskirdami simbolius. Tai buvo paprasti simboliai, pagaminti iš geometrinių figūrų, atspindintys atskirą elementą ir ištirtas transformacijas.
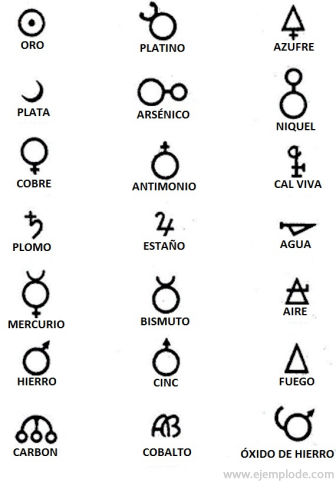
Keli alcheminių simbolių pavyzdžiai su jų atstovaujamo elemento ar junginio pavadinimu.
Šiuolaikinės chemijos epochoje elementai vis dar vaizduojami simboliais, šiuo atveju raidėmis, nurodančiomis jų vardą lotynų ar anglų kalbomis.
Pavyzdžiui:
Natrio simbolis yra Na, lotynišku pavadinimu Natrium
Aukso simbolis yra Au, lotynišku pavadinimu Aurumas
Sidabro simbolis yra Ag, lotynišku pavadinimu Argentum
Vario simbolis yra Cu, lotynišku pavadinimu „Cuprum“
Antimono simbolis yra Sb, lotynišku pavadinimu Stibium
Geležies simbolis yra Tikėjimas, lotynišku pavadinimu „Ferrum“
Merkurijaus simbolis yra Hg, lotynišku pavadinimu Hidrargija, kuris reiškia „skystas sidabras“
Kalio simbolis yra K., lotynišku pavadinimu Kaliumas
Cheminių elementų grupės:
Periodinėje cheminių elementų lentelėje jie klasifikuojami pagal grupes: A ir B grupės. A grupės yra aštuonios, kuriose yra elementai Šarminis, Šarminis-žemiškas, Terreos, trys Elementų šeimos, kurių galva apibrėžia šeimos vardą: Anglies šeima, Azoto šeima, Sieros šeima, Halogenai ir Tauriosios dujos. B grupę sudaro visi Pereinamieji metalai ir retosios žemės, kurios taip pat yra dvi puikios šeimos: Lantanidai Y Aktinidai.
IA grupė: šarminiai elementai:
Šarminių elementų seriją sudaro vandenilis (H), ličio (Li), natrio (Na), kalio (K), rubidžio (Rb), cezio (Cs) ir franko (Fr). Visi jie turi tokią elektroninę konfigūraciją, kad paskutiniame apvalkale jie turi elektroną. Jų vardas yra dėl to, kad, kontaktuodami su vandeniu, jie reaguoja, kad susidarytų šarmai arba hidroksidai. Tai yra bendras elgesys tarp šių elementų. Kuo didesnis elemento atomas, tuo jis yra reaktyvesnis, nes jėga, su kuria branduolys sulaiko elektroną iš paskutinio apvalkalo, pasiekia vis mažiau. Jie sugeba sudaryti jonines jungtis su halogenais. Pavyzdžiui: joninis ryšys, kuriame yra daug, yra natrio-chloro jungtis, sudaranti natrio chloridą NaCl.
IIA grupė: šarminiai žemės elementai:
Šie elementai yra: berilis (Be), magnis (Mg), kalcis (Ca), stroncis (Sr), baris (Ba) ir radis (Ra). Jie nėra laisvo pobūdžio; jo karbonatų ir silikatų yra gana daug. Jie yra Argentinos baltos spalvos ir kristaliniai. Veikiami oro jie lengvai derinami su deguonimi. Iš dalies taip yra dėl to, kad paskutiniame apvalkale jie turi du elektronus, atitinkančius deguonies priėmimo pajėgumus. Baris yra aktyviausias grupės elementas, o kartu su kalciu jie turi daugiausia pramoninių pritaikymų grupėje.
IIIA grupė: Žemės elementai:
IIIA grupę sudaro boro (B), aliuminio (Al), galio (Ga), indžio (In) ir talio (Tl) elementai. Boras yra nemetalinis elementas, aliuminis yra amfoterinis (amfrotrinis), tai yra, jis gali veikti kaip rūgštis ir kaip bazė; o kiti trys yra metaliniai elementai. Paskutiniame apvalkale jie turi tris elektronus, generuojančius +3 valentingumą, nors kartais kai kurių jo junginių galis veikia su +1 ir +2 valencija. Boras yra vienintelis šios serijos elementas, formuojantis hidridus. Boras ir aliuminis sudaro karbidus.
IVA grupė: Anglies šeima:
Tipiniai IVA grupės elementai yra anglis (C), silicis (Si), germanis (Ge), alavas (Sn) ir švinas (Pb). Pirmieji du iš esmės yra nemetaliniai pagal savo charakteristikas, tačiau germanis, alavas ir švinas yra metaliniai, tuo labiau, kuo didesnis jų atominis skaičius. Išskyrus silicį, kiekvieno elemento valentingumai yra +4 ir +2.
Anglis ir silicis sudaro junginius, kuriuose elementų atomai sujungiami bendrų elektronų poromis. Anglis yra organinių junginių esmė, jungiantis su vandenilio, deguonies, azoto, sieros ir kartais silicio atomais.
Elektroninis komponentų gamybai naudojamas silicis ir germanis, nes jie turi savybę elgtis kaip puslaidininkiai.
VA grupė: Azoto šeima:
VA grupę sudaro elementai: azotas (N), fosforas (P), arsenas (As), stibis (Sb) ir bismutas (Bi). Azotas ir fosforas yra nemetaliniai, arsenas ir stibis yra metaloidai, o bismutas yra metalas. Šiems elementams būdingi hidridai, iš kurių mažiausiai toksiškas yra amoniakas NH3. Azotas sudaro azoto rūgštį HNO3, kartu su druskos rūgštimi Agua Regia, mišinyje, kuris gali ištirpinti tauriuosius metalus, tokius kaip auksas ir sidabras.
Azotas taip pat dalyvauja dviejose didelėse organinių junginių grupėse, vadinamose aminais ir amidais, kurie gali būti laikomi amoniako NH dariniais.3, pakeisdamas vandenilį angliavandenilių grandine.
VIA grupė: Deguonies šeima:
Susideda iš deguonies (O), sieros (S), seleno (Se), telūro (Te) ir polonio (Po) elementų. Deguonis yra pats aktyviausias ir turi galimybę lengvai suformuoti kovalentinius ryšius. Susilietęs su metalais didelės drėgmės aplinkoje, susidaro oksidai. Tai sudaro rezonansinę molekulę, vadinamą Ozonu, kuri apsaugo planetą nuo UV spindulių.
VIIA grupė: Halogenai:
Jo pavadinimas reiškia „Pardavimų formuotojai“. Grupę sudaro elementai Fluoras (F), Chloras (Cl), Bromas (Br), Jodas (I) ir Astatas (At). Paskutiniame apvalkale jie turi septynis elektronus, o tai leidžia jiems būti vieno elektrono receptoriais. Dėl šios savybės jie jungiasi su IA grupės elementais, susidaro dvejetainės druskos. Fluoras pasižymi didžiausia elektronegatyvumu iš visos periodinės lentelės, kurio vertė yra 4,0, o jo atitikmuo yra cezis, su elektronegatyvumu 0,7. Ši savybė suteikia jai jėgų pritraukti kitus atomus ir teikti pirmenybę ryšiui užmegzti jie.
VIIIA grupė: tauriosios dujos:
Dar vadinama inertinių dujų grupe, ją sudaro elementai: helis (He), Neonas (Ne), Argonas (Ar), Kriptonas (Kr), Ksenonas (Xe) ir Radonas (Ra). Jie yra visos elektroninės konfigūracijos elementai, todėl jie negali reaguoti įprastomis sąlygomis. Jie daugiausia naudojami šviečiantiems komerciniams ženklams, skleidžiantiems matomą šviesą, kai jiems įvyksta elektros srovė.
B grupė: pereinamieji metalai:
Dešimt grupių po tris elementus grupuojami pereinamieji metalai. Tai geriausi elektros laidininkai: sidabras (Ag), varis (Cu), auksas (Au); geriausi miesto statybų ir inžinerijos konstrukciniai komponentai; Geležis (Fe), titanas (Ti), aliuminis (Al), cirkonis (Zr), volframas (W); geriausi katalizatorių komponentai: nikelis (Ni), vanadis (V), platina (Pt); ir pagrindiniai dangos ingredientai: kadmis (Cd), chromas (Cr), cinkas (Zn). Paprastai jie tvarko valentus tarp +1 ir +3, tačiau tokie elementai kaip „Chromium“ tvarko valentus +2, +3, +6.
Retos žemės: lantanidai ir aktinidai:
Jie vadinami retomis žemėmis dėl jų trūkumo planetoje. Juos sudaro dvi grupės: lantanidai ir aktinidai. Jie yra dviejose atskirose periodinės lentelės eilutėse. Jie paprastai dirba su +3 valentingumu ir linkę sudaryti hidroksidus. Svarbiausias jų elementas yra ceris, kuris naudojamas gaminant piroforinius lydinius (lydinį Mischmetalas, lengvesniems akmenims), apšvietimo dujų žarnose ir specialių stiklų, sugeriančių ultravioletinius spindulius ir šilumos spindulius, gamyboje.
Galingiausi radioaktyvūs elementai, tokie kaip uranas (U) ir plutonis (Pu), yra šių grupių dalis. kurie, atsižvelgiant į jų nestabilumą, išleidžia energiją ir suyra, praranda alfa daleles ( Helis). Vėliau, pasak radioaktyviųjų serijų, jie tampa mažiau nestabiliais elementais.


