Halogenų charakteristikos
Chemija / / July 04, 2021
Halogenai yra cheminiai elementai, esantys VIIA arba 17 periodinės lentelės grupėse. Jį sudaro fluoro, chloro, bromo, jodo ir astato elementai.
Halogeno pavadinimas kilęs iš graikų kalbos ir reiškia „druskų gamintojas“, nes šie elementai su natriu sudaro druskas, panašias į paprastąją.
Bendros halogenų savybės:
Jie yra vienvalentiai elementai, tai yra, jie turi tik vieną valentinį skaičių. Halogenuose valentingumas yra -1.
Jie turi afinitetą vandeniliui, formuodami vadinamuosius vandenilio rūgštis.
Jie turi mažai afiniteto deguoniui, todėl susidaro ne oksidai, o esant labai aukštai temperatūrai.
Jie sujungiami su metalais ir susidaro halogeno druskos.
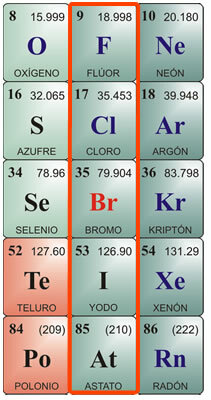
Individualios halogenų savybės:
Fluoro charakteristikos:
Cheminis simbolis F. Atomo skaičius 9, atominė masė 19. Grynas fluoras yra geltonos spalvos dujos, lydymosi temperatūra –223 ° C, o virimo temperatūra –187 ° C. Gamtoje jis neegzistuoja laisvai, todėl turi būti izoliuotas. Pirmą kartą jis buvo izoliuotas 1886 m. Jo fizinės savybės yra: žalsvai geltonos spalvos dujos, labai ėsdinančios ir dirginančios, turinčios aštrų kvapą, nuodingos žmonėms ir gyvūnams. Sunku suskystinti. Cheminės savybės: Jis derinamas su vandeniliu net esant labai žemai temperatūrai su egzotermine reakcija. Jis jungiasi su metalais, formuodamas druskas. Jis skaido druskos rūgštį, gamindamas chlorą, ir skaido vandenį, išskirdamas deguonį. Dėl savo afiniteto vandeniliui jis paima jį iš organinių medžiagų, jas anglindamas. Vienas pagrindinių jo junginių yra vandenilio fluorido rūgštis, kurią galima laikyti tik platinos ar vaško indeliuose, nes ji atakuoja silicio dioksido stiklą. Tai labai nepastovi ir labai ėsdinanti. Kartu su metalais jis gamina fluoridus.
Chloro charakteristikos:
Cheminis simbolis Cl. Atomo skaičius 17, atominė masė 35,5. Lydymosi temperatūra - 102 ° C, virimo temperatūra -37 ° C. Chloras buvo atrastas 1774 m., O išskirtas 1811 m. Fizinės savybės: Tai žalsvai geltonos spalvos dujos, kurių gamtoje nėra laisvų, nes jos paprastai būna sujungtos druskose. Jis turi dusinantį ir nuodingą kvapą. Cheminės savybės: Chloras yra labai panašus į vandenilį, jungiantis egzoterminės reakcijos metu, gaunant druskos rūgštį. Druskos rūgštis, dar vadinama murato rūgštimi arba garuojančia druska, buvo žinoma nuo senovės Romos. Jis rastas dujinės būsenos ugnikalniuose ir ištirpęs kai kurių upių, esančių šalia ugnikalnių, vandenyje. Jis labai ėsdina odą ir yra nuodingas, jei prarijamas. Ją gamina skrandis virškinimui. Kiti svarbūs chloro junginiai yra hipochloritai, ypač natrio hipochloritas, kuris, ištirpęs vandenyje, naudojamas kaip vandens baliklis, dezinfekantas ir steriliklis. Neutralizuoja rūgštis.
Bromo charakteristikos:
Cheminis simbolis Br. Atomo skaičius 35, atominė masė 79,9. Lydymosi temperatūra -7,3 ° C, virimo temperatūra 58,8 ° C. Gamtoje jis nėra laisvas, tačiau kartu su metalais susidaro bromidai. Jis išskiriamas elektrolizės būdu. Fizinės savybės: Tai tamsiai raudonas skystis su dirginančiu kvapu; kambario temperatūroje išskiria dirginančius tankius oranžinės raudonos spalvos garus, sukeliančius kosulį ir ašaras; Tai nuodinga. Jis ištirpsta eteryje arba chloroforme ir beveik netirpsta vandenyje. Cheminės savybės: Bromas atakuoja organines medžiagas; gyvose būtybėse jis ėsdina odą ir sukelia sunkiai gyjančias opas. Pagrindinis jo panaudojimas derinamas su metalais, kurie sudaro bromidus, naudojamus pramonėje, pavyzdžiui, sidabro bromidu, kuris anksčiau buvo naudojamas fotografijoje. Jie taip pat naudojami mažomis koncentracijomis kaip antiseptikas. Kartu su vandeniliu susidaro vandenilio bromido rūgštis, bespalvės aštraus kvapo ir skonio dujos, naudojamos daugiausia metalams atakuoti ir bromidams gauti.
Ypatybės Jodas:
Cheminis simbolis I. Atomo skaičius 53, atominė masė 126,9. Lydymosi temperatūra 113 ° C; virimo temperatūra 184 ° C. Gamtoje jis neegzistuoja laisvai. Jis randamas kaip jodidai jūros dumblių lysvėse ir kaip mineralų dalis kai kuriuose maisto produktuose, pavyzdžiui, rėžiukuose, menkių aliejuje ir vėžiagyviuose. Fizinės savybės: Jodas yra vientisas, kristalinis kūnas, juodai pilkos spalvos, metalinio blizgesio, stipraus ir nemalonaus kvapo. Jis blogai tirpsta vandenyje ir labai gerai tirpsta alkoholyje. Cheminės savybės: Jis derinamas su metalais, sudarančiais jodidus; taip pat su metaloidais, tokiais kaip siera ir fosforas. Jis pasižymi didesniu afinitetu deguoniui nei kiti halogenai. Kartu su amoniaku susidaro azoto jodidas, kuris yra sprogios dujos. Kartu su vandeniliu susidaro hidrojodinė rūgštis, bespalvės aštraus kvapo ir skonio dujos, kurios rūko esant orui. Jis ištirpsta vandenyje ir suyra veikiant šviesai ir šilumai. Jei rūgšties molekulėje yra deguonies, susidaro jojo rūgštis, kuri yra kristalinė kieta medžiaga, pasižyminti oksidacinėmis savybėmis. Jodas naudojamas alkoholiniame tirpale kaip dezinfekantas ir antiseptikas.
Ypatybės Astatus:
Tuo simbolis. Atomo skaičius 85, atominė masė 210. Gamtoje jis neegzistuoja laisvai. Lydymosi temperatūra 254 ° C; virimo temperatūra 962 ° C. Astatinas pirmą kartą buvo susintetintas 1940-aisiais, nes tai yra elementas, išsiskiriantis alfa spinduliais skaidant bismuto atomus. Tai radioaktyvus elementas, turintis labai trumpą gyvenimą; ilgiausiai trunkantis izotopas yra At210, kurio maksimalus tarnavimo laikas yra apie 8 valandas. Manoma, kad jo cheminės savybės yra labai panašios į jodo; fiziškai jis gali būti panašesnis į metalų išvaizdą ir savybes. Nepaisant radioaktyvaus elemento, jis nekelia pavojaus sveikatai, nes paprastai jo nėra gamtoje. Laboratorijoje jis naudoja tik keletą būdų žymėti atomus tiriant subatomines medžiagas.