Daltono dėsnio pavyzdys
Chemija / / July 04, 2021
Anglų mokslininkas Johnas Daltonas (1766-1844) buvo fizikas ir chemikas, daug prisidėjęs prie elementų ir cheminių medžiagų suspaudimo ir klasifikavimo. Tarp pagrindinių jo indėlių yra pirmasis atomų ir junginių vaizdavimo per grafinį vaizdą modelis. Jis taip pat suformulavo vadinamąjį „kelių proporcijų įstatymą“, dar vadinamą Daltono įstatymu.
Kalbėdamas apie cheminius derinius, Louisas Proustas (1754–1826) suformulavo „Pastovių proporcijų dėsnį“, kuriame jis renka pastebėjimas, kad cheminės medžiagos visada jungiasi ta pačia proporcija, kad gautų tuos pačius junginius. Tai yra, jei vandenilis ir deguonis sujungiami, jie visada sujungs tas pačias proporcijas, kad gautų vandenį. Tačiau šis įstatymas nepaaiškino, kaip egzistuoja skirtingi junginiai, sudaryti iš tų pačių medžiagų.
Savo atomine teorija Daltonas suprato, kad sujungus kai kurias paprastas medžiagas jos gali gaminami skirtingi junginiai ir kad vienos medžiagos kiekis skiriasi proporcinga proporcija paprastas.
Daltono įstatymas yra išdėstytas taip:
Elemento, susijungiančio su tuo pačiu kito kiekiu, svoris, sudarant skirtingus cheminius junginius, skiriasi priklausomai nuo labai paprasto ryšio.Tai reiškia, kad jei žinome, kaip medžiagos derinamos paprastomis proporcijomis, o vienos medžiagos kiekis išlieka pastovus, o kitos - dar daugiau medžiagą mes pateikiame paprasta proporcija, kaip santykį 2, 3 arba 4, palyginti su pradine proporcija, kiekvienu atveju gausime medžiagą skirtingi. Tai atsitinka, pavyzdžiui, derinant fosforą, vandenilį ir deguonį.
Jei sujungsime 1 tūrį fosforo, 3 tūrius vandenilio ir 2 tūrius deguonies, gausime hipofosforo rūgštį:
P + 3H + 2O -> PO2H3
Jei ankstesnėje reakcijoje mes keičiame tik deguonį paprasta 2 dalimi, gausime fosforo rūgštį:
P + 3H + 4O -> PO4H3
Reikia atsižvelgti į tai, kad tuo metu atominės valentikos sąvoka dar nebuvo žinoma, taigi nebuvo tiksliai žinoma, kodėl kai kurias medžiagas galima derinti kintamomis proporcijomis, o kitas ne.
Daltono dėsnio pavyzdys
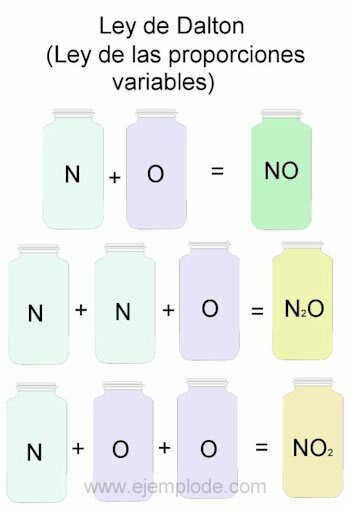
Daltono dėsnio pavyzdžiui imsime azoto (N) ir deguonies (O) derinius.
Sujungus juos ta pačia proporcija, ty po vieną, gausime azoto oksidą:
N + O -> NE
Jei išlaikysime pastovų azoto tūrį ir keisime deguonį 2, gausime azoto peroksidą:
N + 2O -> NE2
Jei, remdamiesi azoto oksidu, dabar išlaikysime deguonies pastovumą ir keisime azoto tūrį 2, gausime azoto oksidą:
2N + O -> N2ARBA
Jei straipsnis buvo jums naudingas, nepamirškite duoti mums +1.



