Peptidų obligacijų pavyzdys
Chemija / / July 04, 2021
The Peptido obligacija yra ta, kurioje dvi amino rūgščių molekulės sujungiamos kondensacijos būdu.
Norint geriau suprasti peptidinius ryšius, pirmiausia reikia apibrėžti amino rūgštis:
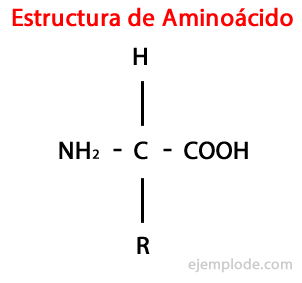
The Aminorūgštys yra organinės molekulės trumpas, kuriame yra bent jau amino grupė (-NH2), šarminio pobūdžio, ir karboksilo grupė (-COOH), rūgštinio pobūdžio.
Nors gyvos būtybės skirtingiems tikslams sintetina labai įvairias aminorūgščių rūšis, svarbiausios yra tos, kurios yra baltymų dalis, visi jie priklauso α-aminorūgštys.
Α-aminorūgštims būdinga tai, kad rūgščių ir amino grupės yra prijungtos prie to paties anglies atomo, vadinamos α anglimi. Be to, ši α anglis kaip trečias pakaitas suriša vandenilio atomą ir kaip ketvirtą pakaitas, papildoma įvairaus dydžio ir savybių grupė, kuri atskiria kiekvieną aminorūgštį nuo kiti.
Vadinamas ketvirtasis pakaitas Šoninės grandinės amino rūgšties ir dažnai supaprastinta forma pateikiama R raide.
Kadangi keturi α-anglies pakaitalai yra skirtingi ir aplink juos išsidėsto tetraedriniu išdėstymu, esančios α-aminorūgštys
optinė izomerija, kai molekulė turi a pakaitinė forma kad atrodo kaip veidrodinis vaizdas jo, kuris galų gale nėra lygi molekulė. Šioms dviem izomerinėms molekulės formoms priskiriamos D arba L raidės, atsižvelgiant į tai, kaip pakaitalai išsidėstę erdvėje. Visos aminorūgštys, esančios baltymuose, yra L.Aminorūgštys klasifikuojamos pagal jų cheminę savybę „Polar“ ir „Apolar“. Savo ruožtu poliarai yra suskirstyti į Neutralus ir įkrautas (kuris gali būti rūgštus arba bazinis). The Nepolinis gali būti alifatinis arba aromatinis.
Peptidai ir peptidinis ryšys
Peptidai yra aminorūgščių kovalentinės jungties per amidinius ryšius rezultatas, susidarantys kondensuojamas vieno ir kito amino karboksilo galas, išskiriant vandens molekulę reakcija. Ši sąjunga vadinama „Peptide Bond“.
Šios reakcijos mechanizmas pateiktas žemiau, kuriame Amino ir karboksilo grupės, ir susidaro amino rūgšties molekulių kondensatas, kad susidarytų peptidas.
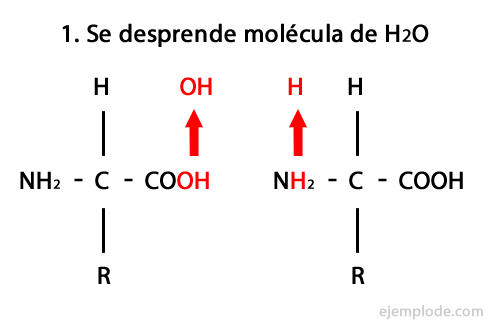
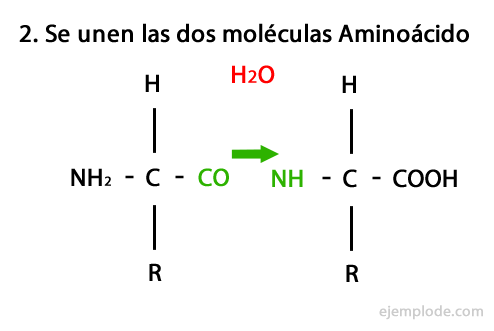

Peptidai, kaip aminorūgštys ir baltymai, galuose turi amino grupę ir karboksilo grupę nereaguodamas.
Norint nurodyti paprasto peptido ir net baltymo formulę, pakanka išvardyti jį sudarančias amino rūgštis, pradedant nuo nemokamos „Amino“ grupėsir baigiant tuo, kuris pateikia savo karboksilo grupę.
Kai kurie organizme esantys peptidai yra Vasopresinas, kuris padidina kraujospūdį ir padidina vandens reabsorbciją inkstuose; Enkefalinas, kuris sumažina skausmo pojūtį; ir Oksitocinas, dėl kurio gimda susitraukia.
Peptidų obligacijų charakteristikos
Vienos aminorūgšties aminogrupės kondensatas su kitos karboksilu, vyksta vandeniniame tirpiklyje, taip kad tai nėra spontaniška, todėl baltymų sintezei reikia energijos.
Peptidinis ryšys, kaip ir bet kuriame amido ryšyje, pateikia rezonansą tarp dviejų kraštutinių formų: neutrali forma, kurio vienintelis ryšys jungia pirmosios aminorūgšties karbonilo anglį ir antrosios aminorūgštį (C-N), ir forma su mokesčių atskyrimu kuriame du atomai yra susieti dviguba jungtimi (C = N). Iš tikrųjų peptidinis ryšys nepriima nė vienos iš dviejų kraštutinių situacijų, tačiau yra abiejų rezonansinis hibridas.
Yra skambutis Peptidų lėktuvas, susidedantis iš visų peptidų junginyje dalyvaujančių atomų, jungiančių dvi pradines aminorūgštis. Viena vertus, azoto ir vandenilio atomai, turintys atitinkamą anglies α pirmojoje aminorūgštyje. Kita vertus, kitos aminorūgšties anglis α su karbonilo grupės deguonimi ir anglimi.
Skirtumai tarp peptidų ir baltymų
The peptidai turi mažai aminorūgščių, kuris svyruoja nuo dviejų iki kelių dešimčių jų, o jų forma tirpale tampa lanksti.
maži baltymai, struktūriškai artimi dideliems peptidams, turi a apibrėžta konformacija ir daug mažiau lanksti.
Yra baltymų, kurie, kaip ir peptidai, turi netvarkingą ir lanksčią konformaciją, tačiau tokia tvarka, kai jie sąveikauja su kitomis ląstelės makromolekulėmis.
20 aminorūgščių, dalyvaujančių klijuojant peptidus, pavyzdžių
- Wisteria
- Mergaitei
- Valine
- Leucinas
- Izoleucinas
- Proline
- Metioninas
- Fenilalaninas
- Tirozinas
- Triptofanas
- Serine
- Treoninas
- Cisteinas
- Asparaginas
- Glutaminas
- Asparto rūgštis
- Glutamo rūgštis
- Lizinas
- Argininas
- Histidinas