Cheminės energijos pavyzdys
Chemija / / July 04, 2021
The Cheminė energija yra ta, kuri atsiranda dėl cheminių reakcijų. Sąveika tarp cheminių medžiagų sukuria ryšių nutrūkimą ir (arba) susidarymą, o tai reiškia atitinkamai energijos išsiskyrimą arba absorbavimą. Cheminė energija vadinama išsiskiriančia energija, kuri gali būti naudojama, pavyzdžiui, kaip šiluminė energija ir elektros energija.
Energija cheminėse reakcijose
Didžiausią cheminę energiją galima gauti iš dviejų pagrindinių šaltinių: degimo ir elektrolitinių tirpalų. Kita vertus, žmogaus kūno lygmenyje galima gauti energijos chemiškai skaidant maistą.
Degimo energija
Pavyzdžiui, kai degalų metano CH4, paprasčiausias angliavandenilis, pradeda degti dalyvaujant deguonies oksidatoriui, jis suyra ir susidaro anglies dioksido CO produktai.2 ir vanduo H.2ARBA. Be to, nutraukus vandenilio atomų ryšius su anglies atomais, energija išsiskirs šilumos pavidalu.
CH4 g) + 2O2 g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 Kcal / mol
Metano degimo lygtis. Šios reakcijos šilumą vaizduoja ΔH. Neigiamas ženklas rodo energijos išsiskyrimą. Reakcija yra egzoterminė.
 Metano dujų deginimas. Reakcija pasireiškia liepsna.
Metano dujų deginimas. Reakcija pasireiškia liepsna.
Organinių junginių degimo 25 ° C temperatūroje pavyzdžiai.
Junginys |
Formulė |
ΔH (Kcal / mol) |
Metanas (g) |
CH4 |
-212.80 |
Etanas (g) |
C2H6 |
-372.82 |
Propanas (g) |
C3H8 |
-530.60 |
n-butanas (g) |
C4H10 |
-687.98 |
n-Pentanas (g) |
C5H12 |
-845.16 |
Etilenas (g) |
C2H4 |
-337.23 |
Acetilenas (g) |
C2H2 |
-310.62 |
Benzenas (g) |
C6H6 |
-787.20 |
Benzenas (l) |
C6H6 |
-780.98 |
Toluenas (l) |
C7H8 |
-934.50 |
Naftalenas (-ai) |
C10H8 |
-1,228.18 |
Sacharozė (-ės) |
C12H22ARBA11 |
-1,348.90 |
Metanolis (l) |
CH3Oi |
-173.67 |
Etanolis (l) |
C2H5Oi |
-326.70 |
Acto rūgštis (l) |
CH3COOH |
-208.34 |
Benzenkarboksirūgštis (-ės) |
C6H5COOH |
-771.20 |
Kad kuras galėtų tiekti visą degimo šilumą, kurią jis gali, jis turi būti dujinės būsenos. Kaip matyti lentelėje, skystas benzenas sukelia degimo šilumą, kuri yra 6,22 Kcal / mol mažesnė už tą, kurią išskiria dujinis benzenas. Tai reiškia, kad norint pakeisti skystą į dujas, reikia investuoti 6,22 Kcal / mol.
Spustelėkite, jei norite gauti daugiau informacijos apie Kuras.
Elektrolitinių sprendimų energija
Elektrolitinis laidininkas yra terpė, kurioje dalyvauja viena ar daugiau joninių rūšių, tai yra išsklaidytas su savo elektros krūviu, leidžiant pro jį praeiti elektros srovei Konstitucija. Elektrolitiniai sprendimai yra elektrolitiniai laidininkai.
Elektrolitiniai laidininkai, be elektrolitų tirpalų, apima Išlydytos druskos, taip pat kai kurios kietos druskos, tokios kaip natrio chloridas NaCl ir sidabro nitratas AgNO3.
Elektronų perdavimas vyksta teigiama ir neigiama jonų migracija link elektrodų. Ši migracija apima ne tik elektros energijos perdavimą, bet ir medžiagos gabenimą iš vienos laidininko dalies į kitą.
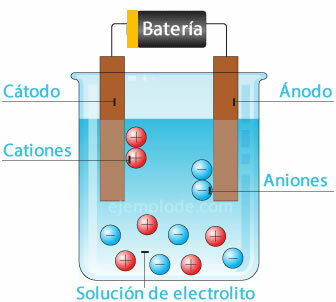 Elektrocheminis elementas
Elektrocheminis elementas
Potencialaus šaltinio prijungimas prie metalinių elektrodų (katodo ir anodo) ir panardinimas į a Vandeninis tirpalas elektronai eis per anodą, kad išeitų iš tirpalo į teigiamą polių fontanas. Tai pasakytina, pavyzdžiui, su chloro jonu, kuris išsiskiria iš jo elektrono, ir jau turėdamas neutralų krūvį, jis prisijungia prie kito chloro atomo, kad susidarytų diatominė molekulė. Iš tirpalo pateks chloro dujos.
2Cl- = 2Cl + 2e-
Elektronai, paliekantys neigiamą šaltinio polių, bus patalpinti panardintame katode. Rūšys, esančios vandeniniame tirpale (jonai), paims elektronus iš katodo. Pavyzdžiui, vandenilio jonai, sudarantys vandenį, turėjo teigiamą krūvį elektronas, kuris turi būti neutralizuotas ir sujungtas su kitu vandenilio atomu, kad susidarytų molekulė diatominis. Iš tirpalo jis išbėgs kaip vandenilio dujos.
2H+ + 2e- = 2H
2H = H2 g)
Šis elektronų mainai gali padėti veikti automobiliams, kurie susideda iš švino Pb elektrodų, panardintų į sieros rūgšties H tirpalą.2SW4.
Ta pati energija gaunama visų tipų akumuliatoriuose, kurie naudojami buitiniame lygmenyje: 9 V, AA, AAA, D, kad būtų keli pavyzdžiai.
Maisto energija
Žmonės įsisavina energiją, kuri išsiskiria skaidant maistą, kurį valgome savo kūne. Tą energiją mūsų kūnas naudoja nesąmoningoms funkcijoms (virškinimui, širdies plakimui, ląstelių funkcijoms) ir toms, kurias mes atliekame.
Kol jūs nesate intensyvus fizinis aktyvumas ir jūsų medžiagų apykaita lėta, patartina reguliariai vartoti kalorijas, nes maisto produktai, kuriuose yra daug lipidai ir sudėtiniai angliavandeniai, turintys labai didelę struktūrą, yra sunkiau skaidomi, todėl jie pasikeičia Energija. Tokiu atveju poveikis akimirksniu būtų priešingas.
Vaisius patartina vartoti tada, kai privalote dirbti naktį, nes vaisiuose yra fruktozės, paprastas angliavandenis, kurį lengva suskaidyti ir kuris turės energijos po mūsų vartojimas.
Cheminė energija ir jos transformacijos
Termoelektriniai įrenginiai
Didelis ir ilgalaikis kaloringumas termoelektrinėse naudojamas sunkiajam kurui. Paprastai tai yra mazutas (mazutas). Degimas, kuris yra cheminis proceso etapas, bus naudojamas kaip katilo šildymo agentas, kuris generuos sočiųjų garų. Šis garas pateks į slėgį per garų paskirstymo tinklą ir pradės judinti generatorių turbinas. Šie prietaisai gamins elektros energiją, kad aprūpintų atitinkamus gyventojus.
Cheminė energija → Mechaninė energija → Elektros energija
Automobilių eksploatavimas
Automobiliai priklauso nuo maitinimo šaltinio, kuris yra akumuliatorius. Baterijoje jau yra žinoma, kad vyksta elektrolitinis laidumas, kuris maitina uždegimo sistemą, brūkšnio priedus ir pagalbinius maitinimo lizdus. Šios turimos elektros energijos dėka automobilis galės judėti, kad nuvežtų vairuotoją į norimą vietą.
Cheminė energija → Elektros energija → Mechaninė energija



