Organinės chemijos pavyzdys
Chemija / / July 04, 2021
Organinė chemija Tai yra bendrosios chemijos dalis, atsakinga už tyrimą ir funkcinį cheminių junginių klasifikavimą, kurio struktūrinis elementas yra Anglis, kurių gausiai yra gyvoji materija; taip sukuriama gerai diferencijuota neorganinės chemijos visata, skirta cheminiams junginiams, priskiriamiems mineralams.
Anglies atomo paskutiniame elektroninės konfigūracijos korpuse yra keturi elektronai. Ši charakteristika kartu su atominiu spinduliu leidžia ją sujungti kovalentinėmis jungtimis su kitomis to paties elemento atomai daugybėje grandinių, sudarantys didelę cheminių junginių įvairovę stabilus.
Galite patikrinti Kovalentiniai ryšiai.
Tokiuose cheminiuose junginiuose, be anglies atomų, kurie suteikia jiems pirminę struktūrą, vandenilio atomai yra pagrindinis anglies valentų papildas. Be to, esant šiai junginių įvairovei yra ir tų, kuriuose įsikiša deguonies atomai, Azotas, halogenai, siera ir net fosforas, šarminiai ir šarminiai žemių elementai bei perėjimas. Priklausomai nuo to, kas dalyvauja molekulėje, tai bus galutinės medžiagos fizinės ir cheminės savybės.
The organiniai junginiai yra visoje gyvoji materija; skatinti ir palaikyti visus biologinės funkcijos, skirtingai nuo neorganinių ar mineralinių medžiagų, kurias žmonės naudojo komerciniais tikslais, eksperimentams ar tam tikroms buitinėms užduotims atlikti.
Organinės chemijos istorija
Iki 1828 m. Organinė chemija ir neorganinė chemija jau buvo atskirta. Organinė medžiaga buvo susijusi su kūryba per a „gyvybinė jėga“ir neorganiniams su negyvaisiais, su mineralu. Atsižvelgiant į šias koncepcijas, negalima tikėtis, kad laboratorijoje organiniai junginiai bus gauti iš neorganinių medžiagų.
Tačiau 1828 m. Friedrichas Wöhleris (1800-1882) pavyko paruošti organinę medžiagą, Karbamido CO (NH2)2, svarbus gyvūnų metabolizmo produktas, gaunamas iš neorganinių junginių. Gydymas Švino cianatas Pb (CNO)2 su Amoniakas NH3 gauti Amonio cianatas NH4CNO; Šis junginys iš tikrųjų susidarė, bet virinant tirpalą, kad kristalizuotų amonio cianatą, jis buvo paverstas karbamidu.
Šis cheminis pokytis yra pavyzdys Vidinis pergrupavimas, kurioje molekulėje esančių atomų skaičius ar klasė nesikeičia, o tik jų tvarka joje. Tokio tipo transformacijos organinėje chemijoje yra labai paplitusios.
Vėliau Wöhlerio atradimas paskatino atsisakyti gyvybės jėgos teorijos visiškai išmesti, po to paruošiant daugelį kitų organinių junginių laboratorija. Nepaisant to, neorganinių ir organinių savybių apibūdinimas išlieka, nes neorganiniai junginiai yra susiję su mineraliniais produktais organiniai junginiai, kurie iš tikrųjų yra anglies ir vandenilio junginiai bei jų dariniai, yra gyvų organizmų gaminami.
Nors bendrosios chemijos dėsniai vienodai taikomi abiem junginiams, įvairios priežastys pateisina ir padaro šį padalijimą būtinu. Taigi organiniai ir neorganiniai junginiai skiriasi skirtingomis savybėmis, pavyzdžiui: jų Tirpumas pageidautina organiniuose tirpikliuose (eteryje, alkoholyje, chloroforme ir kt.) ir atitinkamai vandenyje Stabilumas (organiniai junginiai suyra santykinai žemoje temperatūroje), o Reakcijų pobūdis; neorganiniams junginiams jie yra joniniai, paprasti ir praktiškai momentiniai, o organiniams - kovalentiški, sudėtingi ir lėti.
Organiniai junginiai
Yra žinomi anglies junginiai, kurių grandinės sudaro iki devyniasdešimt atomų. The grandinės Anglies atomai gali būti linijinis ir šakotas ir turi viengubus kovalentinius arba dvigubus arba trigubus ryšius. Yra žinoma, kad daugiau nei 2500 junginių turi tik anglį ir vandenilį (Angliavandeniliai).
Organinių junginių izomerija
Neorganiniuose junginiuose formulė paprastai reiškia vieną junginį; taigi yra tik viena H formulės medžiaga2SW4. Sieros rūgšties molekulėje yra du vandenilio atomai, vienas iš sieros ir keturi deguonies, specifiniu ir unikaliu išdėstymu. Organiniuose junginiuose yra retai taip nutinka. Taigi, pavyzdžiui, yra du junginiai, kurie reaguoja į formulę C2H6Arba: etilo alkoholis arba etanolis ir dimetilo eteris.

Kuo molekulė yra kompleksiškesnė, ty kuo didesnis anglies atomų skaičius, tuo didesnis galimų izomerų skaičius.
Organinių junginių analizė
Organinio junginio analizė apima: kokybinė analizė, kiekybinė analizė ir Funkcinė analizė. Darant prielaidą, kad junginys yra nešvarios būsenos, jis anksčiau buvo išvalytas Kristalizacija, Distiliavimas, Sublimacija, Ekstrahavimasir kt. Grynumo kriterijus gali būti vertinamas pagal jo fizines konstantas, tokias kaip lydymosi temperatūra, virimo temperatūra, tankis, tirpumas, kristalinė forma, lūžio rodiklis ir kt.
The kokybinė analizė Jis patikrinamas ištyrus junginį sudarančius elementus, ypač anglį, vandenilį ir azotą, o kartais ir halogenus, sierą ir fosforą.
The kiekybinė analizė Ji atliekama remiantis kokybinės analizės metodais. Pradinis taškas yra tam tikras medžiagos kiekis, kuris deginamas, o anglies dioksidas surenkamas ir pasveriamas. anglies ir vandens garai, susidarantys anglies ir vandenilio procentinei daliai apskaičiuoti junginys. Kiekybinės analizės rezultatai palengvina GS apskaičiavimą empirinė formulė, nors molekulinę formulę galima rasti tik nustačius medžiagos molekulinę masę. Tačiau problema dar neišspręsta, nes ta pati molekulinė formulė gali atitikti skirtingus izomerus.
Organinių junginių klasifikacija
Pagal savo struktūrą organiniai junginiai skirstomi į junginius alifatinis, aromatingas Y heterociklinis. Alifatiniai junginiai yra susiję su metanu CH4, yra atviros grandinės, išskyrus cikloparafinus, ir turi savo vardą dėl to, kad gyvūniniai ir augaliniai riebalai priklauso šiai grupei.
The aromatiniai junginiai, uždara grandinė, glaudžiai susijusi su benzenu, C6H6ir jie skolingi savo vardą dėl to, kad daugelis jų turi kvapnius, malonius kvapus.
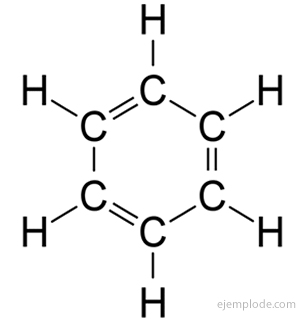
Benzeno žiedas
The heterocikliniai junginiai Tai yra uždaros grandinės junginiai, kurių žiede yra ne anglis, o kitas elementas.
Pagal savo konstituciją jie yra:
Angliavandeniliai, kuris savo ruožtu dėl turimų nuorodų tipo yra klasifikuojamas kaip Alkanai, Alkenai Y Alkynes. Be to, šiai kategorijai priskiriami cikloalkanai, benzenas ir jų dariniai, sudaryti tik iš anglies ir vandenilio.
Heterocikliniai junginiai
Halogeninti dariniai:R-X
Nitro junginiai:R-NE2
Sulfoninės rūgštys:R-SO3H
Nitrilai (ARBA alkilcianidai) ir izonitrilai:R-CN ir R-NC. Jie skiriasi tuo, kaip azoto atomas yra sujungtas molekulėje.
Alkoholiai:R-OH
Fenoliai: Junginiai, kurių pagrindas yra benzolo žiedas su pridėta hidroksilo grupe.

Eteriai:R-O-R
Merkaptanai: R-SH
Tioeteriai:R-S-R
Tio rūgštys:R-COSH
Aldehidai:R-CHO
Ketonai:R-CO-R
Karboksirūgštys:R-COOH
Tu išeini:R-COOM (M metalui)
Esteriai: R-COO-R
Anhidridai: R-CO-O-OC-R
Aminai:R-NH2, R-NH-R, 2R-N-R
Aldosa tipo angliavandeniai:-CHOH-CHOH-CHO
Ketozės tipo angliavandeniai:-CHOH-CO-CH2Oi
Metaliniai organiniai junginiai:R-M-R
Metalo alkilo halogenidai:R-MX (taip pat žinomas kaip „Grignard Reagents“)


