Cheminių jungčių tipai
Chemija / / July 04, 2021
Kai du ar daugiau atomų sudaro molekulę, jie jungiasi kartu naudodami a sandūra tarp elektronų paskutinių jo sluoksnių - paviršutiniškiausių. Ši sąjunga vadinama Cheminis ryšys. Kad susidarytų cheminis ryšys, atomai turi turėti savo nepilnas oktetas, tai yra mažiau nei aštuoni elektronai jų paskutiniame apvalkale, tai yra skaičius, kuris suteiks jiems cheminį stabilumą.
Yra trys cheminių ryšių tipai:
- Joninės jungtys
- Kovalentiniai ryšiai
- Metalinės nuorodos
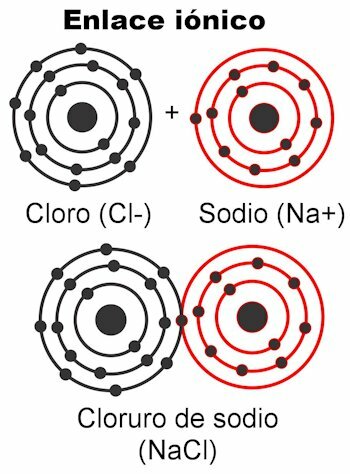
Joninės jungtys
Joninės jungtys yra tos, kuriose valentiniai elektronai traukia elektrostatinės jėgos. Atomas (-ai), turintys 1–4 valentinius elektronus, gali juos perduoti, kad suformuotų ryšį; Tai suteikia teigiamą krūvį, nes tai atsikratytų neigiamų krūvių. Kita vertus, atomas (-ai), turintis 5–7 valentinius elektronus, galės priimti reikiamus, kad pasiektų 8.
Tai suteikia jiems neigiamą krūvį, nes jie surenka elektronus, kurie yra neigiami. Tai, kad elektronai gali būti užfiksuoti arba pristatyti atomai suteikia elektrinį krūvį. Pagal Coulombo įstatymą, abu atomai susidarė
jie ketina pritraukti vienas kitą jėga, kuri yra aukščiau paminėta elektrostatika. Neigiami krūviai pritraukia teigiamus krūvius ir atvirkščiai. Priešingi mokesčiai traukia. Kai ši jėga juos sujungia, molekulė susidaro.Joniniai ryšiai atsiranda daugiausia tarp metalinių ir nemetalinių atomų. Metalai atsisako savo elektronų ir visada turi teigiamą krūvį, dalyvaujantys kaip katijonas (+). Nemetalai yra elektronų receptoriai ir paprastai turi neigiamą krūvį, dalyvauja kaip anijonai (-), bet taip pat atsitinka, kad jie turi teigiamą krūvį, tai, kai jie sudaro krūvį turinčių atomų grupes paskambino radikalai, kaip amonio NH4+, karbonatas CO3-2, fosfatas PO4-3.
Tarp cheminių junginių, kurie susidaro dėl joninių ryšių, yra:
- Dvejetainės druskos
- Oxisales
Kai šios medžiagos ištirpsta vandenyje jie atsiriboja, būtent, atskirti į jų elektrinius krūvius ir jie yra išsklaidyti vandenyje kartu su vandenilio jonais H+ ir hidroksilas (OH-), kurie sudaro vandenį. Susidaręs mišinys yra tirpalas, vadinamas elektrolitas.
- Skaityti toliau: Joninis ryšys
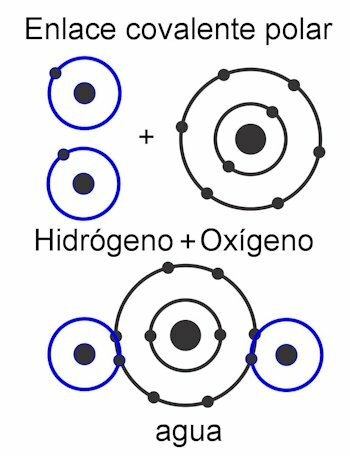
Kovalentiniai ryšiai
Kovalentinės jungtys yra tos, kuriose dalijasi elektronai neatskirdamas jų nuo atomo, tai yra nesusidarant elektriniams krūviams. Atomus laiko artumas ir jie naudoja jėgą, kuria branduolys traukia elektronus. Susiformavus ryšiui, du ar daugiau atomų branduolių galiausiai pritraukia bendrus elektronus, taip įvykdydami okteto taisyklę ir padarydami molekulę stabilią.
Yra keletas kovalentinio sujungimo formų, kurios yra:
- Kovalentinis ryšys
- Koordinuoti kovalentinį ryšį
- Poliarinis kovalentinis ryšys
- Nepolinis kovalentinis ryšys
The kovalentinis ryšys Tai visai kaip aprašyta pradžioje. Dalyvaujantys atomai dalijasi elektronais, kad visi turėtų savo pilną oktetą. Elektrinių krūvių čia nėra, nes elektronai neišmetami, jie tiesiog dalijasi.
Viduje konors koordinuoti kovalentinį ryšį tai tik vienas atomas, prisidedantis prie visų ryšiui reikalingų elektronų. Kitas atomas paprasčiausiai susijungia ir paima šiuos elektronus kaip savus. Molekula susidaro taip. Tai yra, pavyzdžiui, sieros rūgšties H atveju2SW4 kurioje siera dalijasi dviem elektronų poromis su deguonies atomais.
Viduje konors polinis kovalentinis ryšys, jėgos tarp atomų yra pasvirusios į vieną molekulės pusę. Tai kai yra skirtingų tipų atomai molekulėje. Ši jėga matuojama Debye vienetais ir kuo didesnė jos vertė vienoje molekulės pusėje, tuo ji bus poliaresnė. Tai reiškia, kad struktūroje yra suformuoti poliai, todėl jiems ir yra suteiktas šis vardas. Jo jėgos yra asimetrinės.
Viduje konors nepolinis kovalentinis ryšys, jėgos tarp atomų yra vienodos visoje molekulėje, todėl jos struktūroje nesusidaro poliai. Jis veikia kaip vienas vienetas, todėl labai sunku, beveik neįmanoma, padalyti jo apkrovų. Dėl to jis netirpsta vandenyje. Tai yra tokių junginių, kaip alkanai, kurių visos molekulės jėgos yra vienodos. Jo jėgos yra simetriškos.

- Skaityti toliau: Kovalentinis ryšys
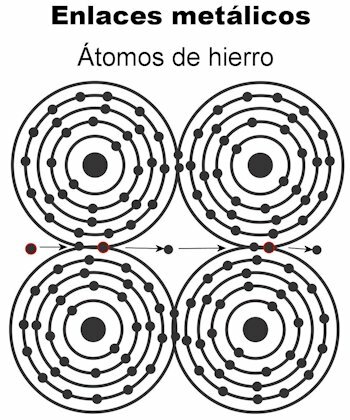
Metalinis ryšys
Metalo atomai laikomi kartu metalinėmis jungtimis. Šio tipo jungtyje visų atomų elektronai pritraukiami, kad susidarytų tvirta kristalinė gardelė. Krištolinės grotelės jungtys turi visus elektronus sutvarkytas elektros srovei ir šilumai nešti kai jis jiems perduodamas. Pereinamuosiuose metaluose ši metalinių jungčių struktūra yra ryškesnė, nes jų atomai yra didesni.
Joninių jungčių pavyzdžiai
Kai kurios medžiagos, turinčios joninius ryšius, yra:
- NaCl natrio chloridas. Jo jonai yra Na+ ir Cl-.
- Kalio chloridas KCl. Jo jonai yra K+ ir Cl-.
- Kalcio chloridas CaCl2. Jo jonai yra Ca+2 ir Cl-.
- Magnio chloridas MgCl2. Jo jonai yra Mg+2 ir Cl-.
- Stroncio chloridas SrCl2. Jo jonai yra Sr+2 ir Cl-.
- Bario chloridas BaCl2. Jos jonai yra Ba+2 ir Cl-.
- Aliuminio chloridas AlCl3. Jo jonai yra Al+3 ir Cl-.
- Na natrio sulfatas2SW4. Jo jonai yra Na+ Ir taip4-2.
- Kalio K sulfatas2SW4. Jo jonai yra K+ Ir taip4-2.
- Kalcio sulfatas CaSO4. Jo jonai yra Ca+2 Ir taip4-2.
- Kalcio sulfatas MgSO4. Jo jonai yra Mg+2 Ir taip4-2.
- Stroncio sulfatas SrSO4. Jo jonai yra Sr+2 Ir taip4-2.
- Bario sulfatas BaSO4. Jos jonai yra Ba+2 Ir taip4-2.
- Na natrio fosfatas3PO4. Jo jonai yra Na+ ir PO4-3.
- Kalio K fosfatas3PO4. Jo jonai yra K+ ir PO4-3.
- Magnio fosfatas Mg3(PO4)2. Jo jonai yra Mg+2 ir PO4-3.
- Kalcio fosfatas Ca3(PO4)2. Jo jonai yra Ca+2 ir PO4-3.
- Aliuminio fosfatas AlPO4. Jo jonai yra Al+3 ir PO4-3.
- Geležies fosfatas Fe3(PO4)2. Jo jonai yra Fe+2 ir PO4-3.
- Geležies fosfatas FePO4. Jo jonai yra Fe+3 ir PO4-3.
Kovalentinio sujungimo pavyzdžiai
Kai kurios kovalentinius ryšius turinčios medžiagos yra:
- Metanas CH4.
- Etanas C.2H6.
- Propanas C3H8.
- Butanas C4H10.
- Pentanas C5H12.
- Heksanas C6H14.
- Heptanas C7H16.
- Oktanas C8H18.
- Propileno CH2= CH2–CH3.
- Acetilenas C2H2.
- Metilo alkoholis CH3
- Etilo alkoholis C2H5
- Propilo alkoholis C3H7
- Izopropilo alkoholis CH3CH (OH) CH3.
- 2-propanonas arba acetonas CH3Automobilis3.
- Formaldehidas HCHO.
- Acetaldehidas CH3
- Propionaldehido CH3CH2
- Butiraldehido CH3CH2CH2
- Skruzdžių rūgštis HCOOH.
Metalinio ryšio pavyzdžiai
Kai kurios metalinį ryšį turinčios medžiagos yra:
- Cinkas Zn
- Kadmio CD
- Varis Cu
- Sidabras Ag
- Auksas Au
- Nikelio Ni
- Palladium Pd
- Platinos Pt
- Kobalto Co
- Rodis Rh
- Iridium Go
- Geležies Fe
- Ruthenium Ru
- Osmium Os
- Mangano Mn
- Chromo kr
- Molibdenas Mo
- Wolfram W
- Vanadis V
- Zrconium Zr
Sekite su:
- Atomai
- Jonas
- Metalai
- Be metalų
- Alkanai
- Sprendimai

