Boyle'o dėsnio pavyzdys
Fizika / / July 04, 2021
Tiriant dujų savybes, Robertas Boyle'as, viena vertus, ir Edme mariotteKita vertus, nežinodami ir nežinodami savo eksperimentų, jie pastebėjo, kad dujos gali būti suspaustos ir kad jų tūris kinta proporcingai slėgiui, kurį jos veikia.
Norėdami suprasti jo tyrimą, turime nepamiršti, kad šiame tyrime reikia atsižvelgti į tris charakteristikas: temperatūrą, tūrį ir slėgį.
Temperatūra: tai temperatūra, kai eksperimento sąlygomis randamos dujos. Tai gali būti išreikšta Celsijaus laipsniais (° C) arba Kelvino laipsniais arba absoliučiu nuliu (° K). Boyle'o dėsnio atveju laikoma, kad temperatūra nesiskiria, tai yra išlieka pastovi.
Tūris: tai vieta, kurią dujos užima uždarytame inde. Pirmiausia dujų tūris yra bako tūris. Pateikiant laikoma, kad talpykla yra uždara ir su stūmokliu, pavyzdžiui, švirkštu.
Slėgis: tai slėgis, kurį dujos turi per stūmoklį. Laikoma, kad uždarytame inde, ant kurio stūmoklis uždedamas kaip dangtis, nedarant slėgio atmosferos slėgis (1 at).
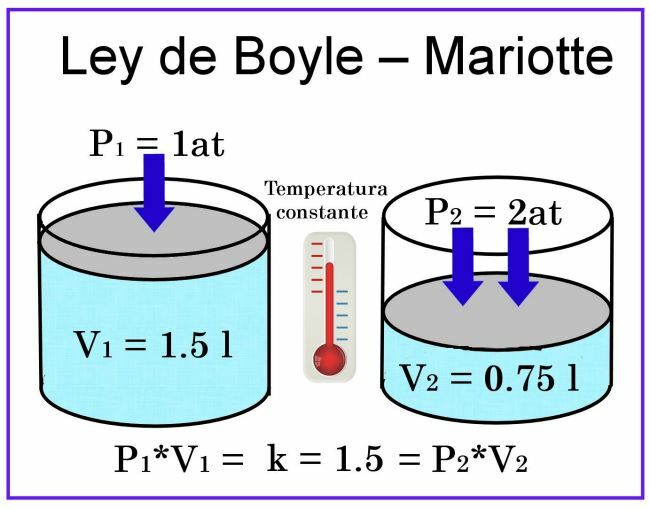
Boyle'o ir Mariotte'o stebėjimuose laikoma, kad temperatūra yra pastovi, todėl matavimui tai neturės įtakos.
Kalbant apie, pavyzdžiui, cilindrinę 1 litro talpos talpą, o jos dangtis yra stūmoklis. slenkant, uždėjus indą, užpildytą oru, slėgis bus 1, o tūris - 1 litro. Jei stūmokliui daromas 2 atmosferų slėgis, dujų tūris sumažės perpus, tai yra, iki 0,5 litro arba 500 ml. Jei slėgis padidės iki 4 atmosferų, tūris sumažės iki ketvirtadalio, tai yra, iki 0,25 litro arba 250 ml.
Remiantis šiais pastebėjimais, kvietimas buvo paskelbtas Boyle'o dėsnis: Esant pastoviai temperatūrai, dujų tūris yra atvirkščiai proporcingas joms daromam slėgiui.
Tai reiškia, kad didėjant slėgiui, tūris mažėja, o slėgiui mažėjant, tūris didėja.
Tai leidžia nustatyti, kad tarp dujų slėgio ir jo tūrio yra ryšys, kuris kinta vienas iš komponentų, kitas skiriasi ta pačia proporcija, santykiai išlieka pastovūs, tai yra sakyk:
P * V = k
P = slėgis
V = tūris
k = slėgio ir tūrio santykio konstanta
Norėdami tai suprasti, tarkime, kad turime 2,5 litro talpos indą, pripildytą oro, o dangtelio stūmoklio slėgis yra 1,5. Taigi jūsų santykių pastovumas yra:
P * V = k = (2,5) (1,5) = 3,75
Jei dabar padidinsime slėgį iki 3 atmosferų, padalinsime k iš slėgio P ir turėsime:
k / P = V
3,75 / 3 = 1,25 litro
Kaip matome, taikant dvigubą slėgį, tūris yra pusė pradinio, o slėgio ir tūrio santykio konstanta išlaikoma. Tai išreiškiama taip:
V1P1 = V2P2 = k
Tai reiškia, kad tūrio, 1 karto didesnio nei 1 slėgio, sandauga yra lygi 2 karto 2 slėgio tūrio sandaugai, ir šis santykis išlieka pastovus.
Boyle-Mariotte įstatymo pavyzdžiai
1 pavyzdys. Apskaičiuokite tūrį, kurį užims 3,75 litro tūrį užimančios dujos, esant 2 slėgiui, jei joms bus taikomas 3,5 slėgis.
V1 = 3,75 l
P1 = 2
V2 = ?
P2 = 3,5
Kaip sakė V1P1 = V2P2 = k
Mes apskaičiuojame sistemos konstantą:
V1P1= k = (3,75) (2) = 7,5
Mes sprendžiame už V2:
V2 = k / P2 = 7,5 / 3,5 = 2 143 litrai
2 pavyzdys. Apskaičiuokite dujų slėgį, jei jis užima 2,25 litro tūrį, jei esant 1,75 slėgiui, jo tūris yra 3,25 litro.
V1 = 3,25 l
P1 = 1,75
V2 = 2,25 l
P2 = ?
Mes apskaičiuojame sistemos konstantą:
V1P1= k = (3,25) (1,75) = 5,6875
Mes sprendžiame už P2:
P2 = k / V2 = 5,6875 / 2,25 = 2,53
3 pavyzdys. Apskaičiuokite pradinį dujų slėgį, jei taikant 4,5 slėgį, jis užima 1,4 litro tūrį, o pradinis jo tūris buvo 2,2 litro.
V1 = 2,2 l
P1 = ?
V2 = 1,4 l
P2 = 4,5
Mes apskaičiuojame sistemos konstantą:
V2P2= k = (1,4) (4,5) = 6,3
Mes sprendžiame už P2:
P1 = k / V1 = 6,3 / 2,2 = 2,863 esant



