20 Skābo sāļu piemēri
Miscellanea / / July 04, 2021
Iekš neorganiskā ķīmija sāļus sauc par savienojumiem, kurus iegūst, kad a skābe tā ūdeņraža atomi tiek aizstāti ar metāla katjoniem (kaut arī dažreiz ar nemetāliskiem katjoniem, piemēram, amonija katjonu, NH4+). Konkrētajā gadījumā skābie sāļi, skābes ūdeņraži ir daļēji aizvietoti, tas ir, vismaz viens neaizvietots ūdeņradis paliek kā sāls daļa. Ar to tos atšķir no neitrāli sāļi, kur skābes ūdeņraži ir pilnībā aizvietoti.
The tu ej ārā parasti veidojas, reaģējot starp a skābe un a hidroksīds (bāze). Šajās reakcijās bāze parasti zaudē hidroksilgrupas (-OH), un skābe zaudē tās. atomi ūdeņradis (H), veidojot neitrālu sāli; bet, ja attiecīgā skābe saglabā vismaz vienu no tās ūdeņraža atomiem, mainot reakcijas elektrisko lādiņu, mēs iegūsim skābes sāli vai hidrogenētu sāli.
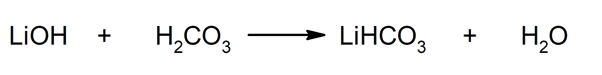
Tā, piemēram, litija hidrogēnkarbonātu un ūdeni iegūst, reaģējot starp litija hidroksīdu un ogļskābi:
Skābju sāļu nomenklatūra
Skābos sāļus var nosaukt pēc trīs veidi visizplatītākā nomenklatūra:
Skābju sāļu piemēri
- Nātrija bikarbonāts (NaHCO3). To sauc arī par nātrija ūdeņraža karbonātu (IV), tas ir balts kristālisks ciets līdzeklis, šķīst ūdenī, un dabā tas ir sastopams stāvoklī minerāls vai to var ražot laboratorijā. Tas ir viens no pazīstamākajiem skābes sāļiem un tiek plaši izmantots konditorejas izstrādājumos, farmakoloģijā vai jogurta pagatavošanā.
- Litija bikarbonāts (LiHCO3). Šis skābes sāls ir izmantots kā CO uztveršanas līdzeklis2 situācijās, kad šāda gāze ir nevēlama, piemēram, Ziemeļamerikas "Apollo" kosmosa misijās.
- Kālija dihidrogēnfosfāts (KH2PO4). Tā ir kristāliska cieta viela, bez smaržas, šķīst ūdenī, ko plaši izmanto dažādās nozarēs, piemēram, ēdiens, helātu veidotājs, uztura bagātinātājs un palīgs fermentācijas procesos.
- Nātrija bisulfāts (NaHSO4). Tas ir skābes sāls, kas veidojas, neitralizējot sērskābi. To rūpnieciski plaši izmanto metālu un tīrīšanas līdzekļu rafinēšanā. Lai gan tas ir ļoti toksisks dažiem adatādaiņiem, to izmanto kā piedevu lolojumdzīvnieku barībā un juvelierizstrādājumu ražošanā.
- Nātrija sērūdeņradis (NaHS). Tas ir bīstams savienojums, ar kuru rīkoties, jo tas ir ļoti kodīgs un toksisks. Tas var izraisīt smagus ādas apdegumus un acu bojājumus, jo tas ir arī viegli uzliesmojošs.
- Kalcija hidrogēnfosfāts (CaHPO4). Gadā to lieto kā uztura bagātinātāju graudaugi liellopiem. Tā ir cieta viela, kas nešķīst ūdenī, bet hidratējot spēj kristalizēties, patērējot divas molekulas no ūdens.
- Amonija ūdeņraža karbonāts ([NH4] HCO3). Pazīstams arī kā "amonija bikarbonāts", to izmanto pārtikas rūpniecībā kā raugu ķīmiska viela, lai gan tā trūkums ir amonjaka slazdošana un ēdiena slikta garša, ja to lieto pārmērība. To lieto arī ugunsdzēsības aparātos, pigmentu izgatavošanā un gumijas paplašināšanai.
- Bari bikarbonātsvai (Ba [HCO3]2). Tas ir skābes sāls, kas karsējot var mainīt tā ražošanas reakciju un ir ļoti nestabils, izņemot šķīdumu. To plaši izmanto keramikas rūpniecībā.
- Nātrija bisulfīts (NaHSO3). Šis sāls ir ārkārtīgi nestabils, un skābekļa klātbūtnē tas iegūst nātrija sulfātu (Na2DR4), tāpēc to izmanto pārtikas rūpniecībā kā pārtikas konservantu un žāvējošu līdzekli. Tas ir ārkārtīgi reducējošs līdzeklis, ko parasti lieto cilvēks, izmanto arī krāsu fiksēšanai.
- Kalcija citrāts (AC3[C6H5VAI7]2). Parasti pazīstams kā rūgtais sāls, to lieto kā pārtikas konservantu un kā uztura bagātinātāju, ja tas ir saistīts ar aminoskābi lizīnu. Tas ir balts kristālisks pulveris bez smaržas.
- Monokalcija fosfāts (Ca [H2PO4]2). Tā ir bezkrāsaina cieta viela, ko iegūst, reaģējot uz kalcija hidroksīdu un fosforskābi, ko plaši izmanto kā fermentu vai kā mēslojumu lauksaimniecības darbos.
- Dikalcija fosfāts (CaHPO4). Pazīstams arī kā kalcija monohidrogēnfosfāts, tam ir trīs dažādas kristāliskas formas, ko izmanto kā piedevu pārtikā un kas atrodas zobu pastās. Turklāt tas dabiski veidojas nierakmeņos un tā sauktajā “nierakmenī”.
- Monomagnija fosfāts (MgH4P2VAI8). Tas ir balts, kristālisks un bez smaržas sāls, daļēji šķīst ūdenī. To lieto pārtikas konservēšanai, kā skābinātāju, kā skābuma korektoru vai līdzekli, ārstējot milti.
- Nātrija diacetāts (NaH [C2H3VAI2]2). Šo sāli ēdienreizēs izmanto kā aromatizētāju un konservantu, kas novērš vai aizkavē sēnes un mikobaktērijas gan vakuumā iepakotos produktos, piemēram, gaļas izstrādājumos, gan miltu rūpniecībā.
- Kalcija bikarbonāts (Ca [HCO3]2). Tas ir hidrogenēts sāls, kas rodas no kalcija karbonāta, kas atrodas tādās minerālvielās kā kaļķakmens, marmors un citi. Šī reakcija ietver ūdens un CO klātbūtni2, tāpēc tas var notikt spontāni alās un alās, kurās ir daudz kalcija.
- Rubīdija skābes fluorīds (RbHF). Šo sāli iegūst fluorūdeņražskābes (ūdeņraža un fluora) un sārma metāla rubīdija reakcijā. Rezultāts ir toksisks un kodīgs savienojums, ar kuru jārīkojas piesardzīgi.
- Monoamonija fosfāts ([NH4] H2PO4). Tas ir ūdenī šķīstošs sāls, kas rodas amonjaka un fosforskābes reakcijā. To parasti izmanto kā mēslojumu, jo tas dod augsnei augsni barības vielas slāpekļa un fosfora daudzums, kas nepieciešams augu augšanai. Tas ir arī daļa no ABC pulvera ugunsdzēsības aparātos.
- Cinka ūdeņraža ortoborāts (Zn [HBO3]). Tas ir sāls, ko izmanto kā antiseptisku līdzekli un kā piedevu keramikas ražošanā.
- Mononātrija fosfāts (NaH2PO4). To galvenokārt izmanto laboratorijās kā "buferšķīdumu" vai buferšķīdumu, kas novērš pēkšņas šķīduma pH izmaiņas.
- Kālija hidrogēnftalāts (KHP). To sauc arī par “kālija skābes ftalātu”, tas ir ciets un stabils sāls parastajā gaisā, tāpēc to bieži izmanto kā primāro standartu pH. Tas ir noderīgs arī kā bufera līdzeklis ķīmiskās reakcijas.
Sekojiet līdzi:



