20 Skābju piemēri
Miscellanea / / July 04, 2021
The skābes veido svarīgu grupu ķīmiskie savienojumi, ļoti plašs. Skābes parasti definē kā savienojumus, kas var ziedot vienu vai vairākus katjonus ūdeņradis (H+) uz citu savienojumu, kas pazīstams kā bāze. Lai gan patiesībā skābes tiek noteiktas pēc vairākām teorijām:
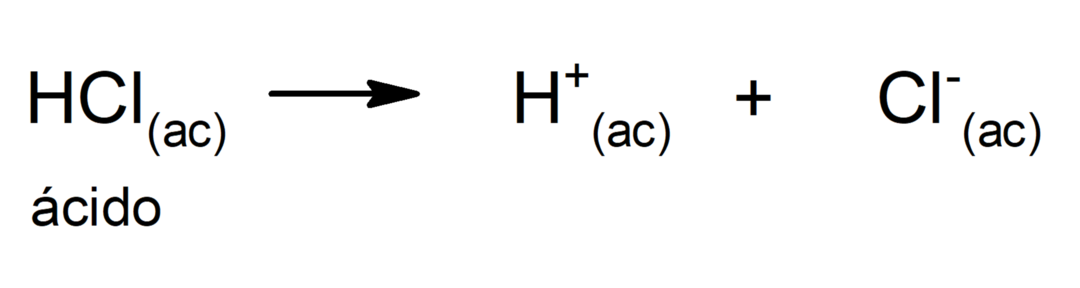 Šīs teorijas ierobežojums ir tāds, ka skābes ir definētas tikai ūdens šķīdumā.
Šīs teorijas ierobežojums ir tāds, ka skābes ir definētas tikai ūdens šķīdumā. 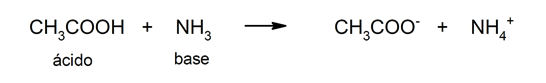

Atbrīvošanās īpašums ūdeņraža katijoni ir tas, kas liek skābēm ražot šķīdumus pH mazāks par 7. Skābes, kas var atbrīvot vairāk nekā vienu protonu (izmantojot šo nosaukumu H+) sauc par poliprotiskām vai daudzfunkcionālām.
Skābes īpašības
Attiecībā uz viņu īpašības, skābes var uzrādīt kā šķidrumi vai kā gāzes, retāk kā ciets. Skābes garša, ko mēs varam atpazīt un kas raksturo šos savienojumus, atrodama, piemēram, citrusaugļi, kas ir bagāti ar citronskābi vai etiķi, kas ir skābes šķīdums etiķains. Tās ir organiskās skābes.
pastāvēt organiskās un neorganiskās skābes; spēcīgākās parasti ir neorganiskās. Daudzām organiskajām skābēm ir svarīga bioloģiskā loma. Starp neorganiskajām ir viena - sālsskābe, kurai ir ļoti svarīga loma gremošanas procesā. The
nukleīnskābes Tie ir arī dzīves pamatprincipi, jo tie ir GEN ģenētiskā materiāla pamatā šūnas un satur atslēgu sintēzei olbaltumvielas.Tieksme zaudēt protonus ir tas, kas nosaka skābes stiprumu.
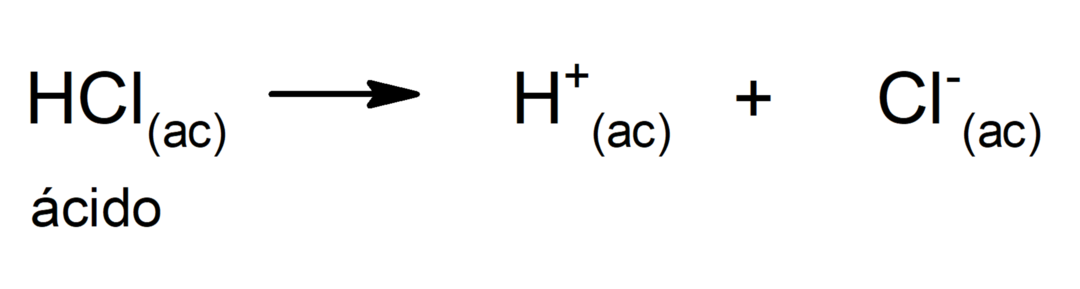
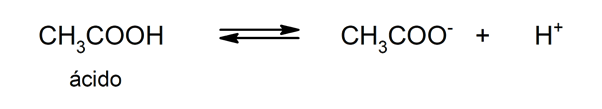
Skābju izmantošana
Skābes ir daudz izmanto, gan rūpnieciskā, gan mājas mērogā. Tos bieži izmanto kā piedevas un konservantus ēdiens, kosmētika, dzērieni utt. Daži skābie cietie materiāli tiek izmantoti kā katalizatori (ķīmisko reakciju paātrinātāji) naftas ķīmijas vai papīra rūpniecībā.
Ir arī skābes, kuras lieto kā dezinfekcijas līdzekļi (karbolskābe, salicilskābe). Turklāt tos var izmantot kā elektrolītus automašīnu akumulatoros, kā tas ir sērskābes gadījumā. Pēdējo spēcīgo skābi bieži izmanto arī minerālvielas, piemēram, mēslošanas līdzekļu ražošanā no akmens fosfātiem.
Ir vērts precizēt, ka noteiktas vielas var izšķīdināt tikai skābā vidē un ka noteiktas reakcijas notiek tikai šādos apstākļos. Slāpekļskābe un amonjaks padara amonija nitrātu arī par nozīmīgu kultūraugu mēslojumu.
Skābju piemēri
Zemāk, piemēram, ir uzskaitītas divdesmit skābes:
- Perhlorskābe (HClO4). Tas ir spēcīgs skābes šķidrums a temperatūra vide, ļoti oksidējoša.
- Slāpekļskābe (HNO3). Tā ir spēcīga un intensīvi oksidējoša skābe, ko izmanto noteiktu sprāgstvielu un arī slāpekļa mēslošanas līdzekļu ražošanai.
- Askorbīnskābe (C.6H8VAI6). Tas ir C vitamīns, kas ir tik nepieciešams veselībai. Tā ir aizsargājoša viela tās antioksidanta iedarbības dēļ.
- Sālsskābe (HClac)). Tā ir vienīgā spēcīgā skābe, ko sintezē cilvēka ķermenis, process, kas īpaši notiek kuņģī, lai veiktu ēdiens gremošanas procesā.
- Vīnskābe (C.4H6VAI6). Tas ir balts kristālisks pulveris, to izmanto putojošo dzērienu pagatavošanai, maizes, vīna un farmācijas rūpniecībā. Zobakmens krēms, ko nes dažas receptes, ir vīnskābe.
- Fluorūdeņražskābe (HFac)). Sakarā ar spēju uzbrukt stiklam, to izmanto kristālu grebšanā un gravēšanā.
- Sērskābe (H2DR4). Tā ir spēcīga skābe par izcilību, tai ir neskaitāmi daudz dažādu pielietojumu nozarēs un sintēzes procesus.
- Trifluoretiķskābe (C.2HF3VAI2). Tas ir labs šķīdinātājs daudziem organiskie savienojumi.
- Fosforskābe (H3PO4). Tas atrodas (mazās koncentrācijās) dažādos kolas dzērienos. To uzskata par kaitīgu veselībai, jo tas veicina atkaļķošanos.
- Etiķskābe (CH3COOH). Tā ir galvenā etiķa sastāvdaļa. Skābums, ko tas rada, padara to par plaši izmantotu pārtikas konservantu.
- Fluorantimonskābe (SbHF6). Tas ir spēcīgākais zināmais superskābe, kas par 10 pārsniedz tīras sērskābes skābumu19.
- Hromskābe (H2CrO4). Tas ir tumši sarkans pulveris, tas piedalās hromēšanas procesā. To lieto arī keramikas glazēšanai.
- Indoletiķskābe (C.10H9NĒ2). Tas ir galvenais auksīnu pārstāvis, kas ir svarīgs augšanas hormonos augi.
- Dezoksiribonukleīnskābe (DNS). Tas ir tas, kurš tur dzīvības atslēgu, jo tas veido gēnus, kas regulē neskaitāmu olbaltumvielu sintēzi.
- Trikarboksilskābes. Tie ietver karbonskābju grupu, kurai ir trīs karbonskābes grupas (-COOH). Citronskābe (C.6H8VAI7) Tas ir viens no tiem.
- Skudrskābe (CH2VAI2). Tas ir vienkāršākais no organiskajām skābēm. Ilgstoša šīs skābes iedarbība var izraisīt elpošanas mazspēju un nāvi.
- Glikonskābe (C.6H12VAI7). Šīs skābes sāļus plaši izmanto stikla trauku tīrīšanas procesos.
- Pienskābe (C.3H6VAI3). Tā ir svarīga bioķīmisko procesu daļa.
- Benzoskābe (C.7H6VAI2). Tā ir skābe ar raksturīgu smaržu, ko plaši izmanto, lai saglabātu pārtikas produktus, kuriem nepieciešams pH skābe.
- Ābolskābe (C.4H6VAI5). To plaši izmanto farmācijas nozarē caurejas līdzekļu ražošanai.
- Ogļskābe (H2CO3). Dažās vietās tā ir daļa no alu veidošanās procesa. Tas ir gāzētos dzērienos.