100 ķīmisko elementu piemēri
Miscellanea / / November 13, 2021
The ķīmiskie elementi ir tāda veida jautājums, kas bez procedūras vai ķīmiskā reakcija tos var samazināt vai sadalīt citos vienkāršākos elementos. Šī iemesla dēļ var teikt, ka elements ir viss jautājums Ražots atomi vienas un unikālas klases, tas ir, atomi, kuriem ir vienāds atomu skaits (vienāds protonu skaits), lai gan tiem ir atšķirīga atomu masa. Piemēram: sērs, bors, hroms, alva.
Pirmo ķīmiskā elementa definīciju ieviesa Lavuazjē plkst Traite Élémentaire de Chimie, 1789. gadā. 18. gadsimtā Lavuazjē vienkāršas vielas iedalīja četrās grupās:
Periodiskā elementu tabula
Šodien viņi viens otru pazīst 118 ķīmiskie elementi. Tie visi ir apkopoti, klasificēti un sakārtoti atbilstoši daudzām to īpašībām grafiskā shēmā, kas pazīstama kā elementu periodiskā tabula, kuru sākotnēji izveidoja krievu ķīmiķis. Dmitrijs Mendeļejevs 1869. gadā. Periodiskā tabula sastāv no 18 grupām (kolonnām) un 7 periodiem (rindām), kuros atrodas ķīmiskie elementi.
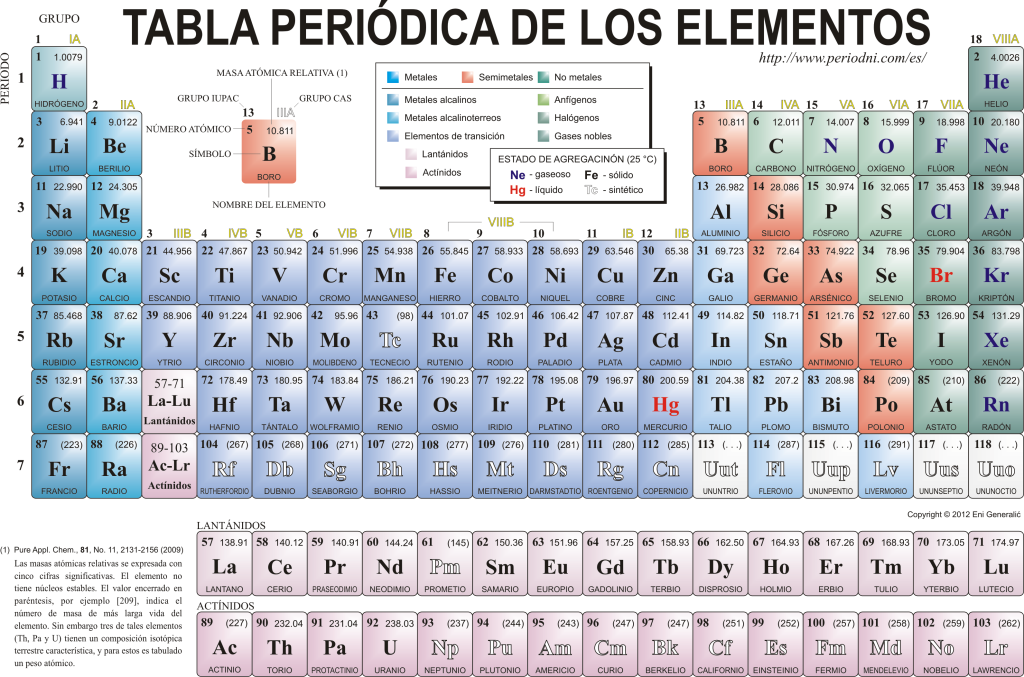
The galvenās grupas kuras var atrast šajā tabulā, ir:
Sārmu metāli (1. grupa), sārmzemju metāli (2. grupa), skandija ģimene, kurā ietilpst zemes un aktinīdi (3. grupa), titāna ģimene (4. grupa), vanādija ģimene (5. grupa), hroma ģimene (6. grupa), mangāna ģimene (7. grupa), dzelzs ģimene (8. grupa), kobalta ģimene (grupa 9), niķeļa ģimene (10. grupa), vara ģimene (11. grupa), cinka saime (12. grupa), zemes elementi (13. grupa), karbonīda elementi, šajā grupā ietilpst Ogleklis, kas veido dzīvības pamatu uz Zemes (14. grupa), slāpekli veidojošie elementi (15. grupa), amfiģenētiskie elementi, ietver skābekli, kas ir pamatelements uz elpošana no dzīvās būtnes (16. grupa), halogēna elementi (17. grupa) un cēlgāzes (18. grupa).
Daudzi no šiem elementiem ir stabili vai radioaktīvi izotopi, tas ir, vienam un tam pašam ķīmiskajam elementam, piemēram, ūdeņradim (H), var būt vairāki izotopi (1H, 2H, 3H). Tas nozīmē, ka katram izotopa atomam ir vienāds protonu skaits (kas nozīmē, ka tas pieder vienam un tam pašam ķīmiskajam elementam) un atšķirīgs neitronu skaits.
Daži izotopi nav stabili (radioaktīvi), tas ir, sadalīties noteiktā laikā izstaro noteiktas daļiņas (cita starpā neitronus, fotonus, alfa daļiņas) un rada citus stabilus vai radioaktīvus izotopus. Ķīmiskajiem elementiem ir tādas īpašības kā punkts vārot un tas no saplūšana, elektronegativitāte, blīvums un jonu rādiuss, cita starpā. Šīs īpašības ir svarīgas, jo ļauj prognozēt tā uzvedību, reaktivitāti utt.
Kā elementi tiek parādīti periodiskajā tabulā?
Katrs ķīmiskais elements ir raksturots Periodiskā tabula izmantojot noteiktu simboliku. Pirmkārt, katras kastes centrā ir tās universālais simbols, kas sastāv no viena vai diviem burti (pēc vienošanās, ja ir divi burti, pirmo raksta ar lielajiem burtiem, bet nākamo ar mazajiem).
Augšpusē un pa kreisi ir redzams mazā šriftā su atomskaitlis, kas norāda šī elementa protonu daudzumu. Zem elementa simbola tiek parādīts tā nosaukums, un augšā, kreisajā pusē, parādās tā nosaukums. atomu masa radinieks. Turklāt krāsa, kurā tiek attēlots elementa simbols, norāda uz tā apkopojuma stāvokli (atbilstoši katrā periodiskajā tabulā izmantotajam attēlojumam).
Ir dažādi elementi atomu rādiusi mainīgie un, palielinoties protonu skaitam kodolā, jo lielāka ir pievilcība, ko kodols iedarbojas uz elektroniem, tāpēc atoma rādiusam ir tendence samazināties. Kad atoma rādiuss ir mazs, elektroni mākoņa visattālākajā līmenī tiek ļoti piesaistīti kodolam, tāpēc tie viegli nepadodas. Pretēji notiek ar elementiem ar augstu atomu rādiusu: tie viegli atdod savus ārējos elektronus.
Tādējādi atomu rādiuss palielinās no augšas uz leju, kad mēs ejam cauri periodiskās tabulas grupām, un samazinās no kreisās uz labo pusi, kad mēs ejam cauri to periodiem.
Ķīmisko elementu piemēri
| Ķīmiskais elements | Simbols |
| Aktīnijs | Ak |
| Alumīnijs | Uz |
| Americium | A.M |
| Antimons | Sb |
| Argons | Ar |
| Arsēns | Ace |
| Astat | Plkst |
| Sērs | S |
| Bārijs | Ba |
| Berilijs | Esi |
| Berķelija | Bk |
| Bismuts | Bi |
| Bohrio | Bh |
| Bors | B |
| Broms | Br |
| Kadmijs | CD |
| Kalcijs | AC |
| Kalifornija | Sal |
| Ogleklis | C |
| Cerijs | EK |
| Cēzijs | Cs |
| Hlors | Cl |
| Kobalts | Co |
| Varš | Cu |
| Chrome | Kr |
| Kūrijs | Cm |
| Darmstadio | Ds |
| Disprozijs | Dy |
| Dubnium | Db |
| Einšteinijs | Tas ir |
| Erbijs | Er |
| Skandijs | Sc |
| Alva | Sn |
| Stroncijs | Mr |
| Eiropijs | Eu |
| Fermijs | Fm |
| Fluors | F |
| Match | P |
| Franciuss | Fr |
| Gadolīnijs | Gd |
| Gallijs | Ga |
| Germānija | Ge |
| Hafnijs | Hf |
| Hassio | Hs |
| Hēlijs | man ir |
| Ūdeņradis | H |
| Dzelzs | Ticība |
| Holmium | Ho |
| indiānis | In |
| Jods | es |
| Iridijs | Iet |
| Iterbijs | Yb |
| Itrijs | UN |
| Kriptons | Kr |
| Lantāns | The |
| Lorencio | Lr |
| Litijs | Li |
| Lutēcijs | Pirmd |
| Magnijs | Mg |
| Mangāns | Mn |
| Meitnerius | Mt |
| Mendeļevijs | Md |
| Merkurs | Hg |
| Molibdēns | Mo |
| Neodīms | Na |
| Neona | Ne |
| Neptūnijs | Np |
| niobijs | Nb |
| Niķelis | Ne viens, ne otrs |
| Slāpeklis | N |
| Nobelio | Nē |
| Zelts | Au |
| Osmijs | Tu |
| Skābeklis | VAI |
| Palādijs | P.S |
| Sudrabs | Ag |
| Platīns | Pt |
| Svins | Pb |
| Plutonijs | Pu |
| Polonijs | Po |
| Kālijs | K |
| Prazeodīms | Pr |
| Apsolīt | P.m |
| Protaktīnijs | Pa |
| Radio | Ra |
| Radons | Rn |
| Rēnijs | Re |
| Rodijs | Rh |
| Rubidijs | Rb |
| Rutēnijs | Ru |
| Rutherfordio | Rf |
| Samarijs | Jā |
| Seaborgio | Sg |
| Selēns | Es zinu |
| Silīcijs | Jā |
| Nātrijs | Na |
| Tallijs | Tl |
| Tantals | Ta |
| Tehnēcijs | Tc |
| Telūrs | Tēja |
| Terbijs | Tb |
| Titāns | Tu |
| Torijs | Th |
| Tulijs | Tm |
| Koperniks | Cn |
| Livermorio | Lv |
| Rentgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Urāns | VAI |
| Vanādijs | V |
| Volframs | W |
| Ksenons | Xe |
| Cinks | Zn |
| Cirkonijs | Zr |

Sekojiet līdzi:



