Molekulārās ģeometrijas definīcija
Miscellanea / / January 11, 2022
Konceptuālā definīcija
Tā ir molekulas struktūra, kas nosaka to atomu trīsdimensiju izvietojumu, kas to veido telpā.

Ķīmijas inženieris
Molekulārās ģeometrijas pašlaik tiek noteiktas, pamatojoties uz Teorija Valensijas slāņa elektronisko pāru atgrūšana (TRPECV). Šī teorija ļauj paredzēt uzvedību ķīmiska vielām (īpaši kovalentām) un palīdz izprast izplatīšana elektronika, kas noved pie ģeometrija no molekula. Tas savukārt ļauj izprast daudzas īpašības, ko vielas iegūst.
Šī teorija ir balstīta uz vairākiem pamatpīlāriem, kurus mēs pārskatīsim un pēc tam mēģināsim tos izprast pieteikumu prakse. Pirmkārt, saistītie un nesaistītie (valences) elektroni tiek uzskatīti par elektronu jūru, kas tiem ir vienāda veida lādiņš, tie atgrūž viens otru, tāpēc tie vienmēr atradīsies tik tālu no centrālā atoma molekula.
Otrkārt, šī elektronu "jūra" jeb "elektroniskais mākonis" veido zonas ar augstu elektronu blīvumu, kas veidojas saitēs, kur elektroni ir kopīgi vai elektronu pāros, kas nav kopīgi. Savukārt saites, kas veidojas, var būt vienkāršās, dubultās vai pat trīskāršās.
Visbeidzot, par izlemt molekulārā ģeometrija, ļoti noderīga ir Lūisa struktūra, kurā tiks skaitīts elektronu blīvums ap centrālo atomu, un tas dos norāde no tās ģeometrijas nosaukuma un formas, ko molekula ieņem trīsdimensiju veidā.
Jāņem vērā, ka šie blīvumi tiks izvietoti pēc iespējas tālāk viens no otra, lai iegūtu visstabilāko struktūru un kur ir mazāka atgrūšanās. Tādā veidā vispirms tiek identificēta elektroniskā ģeometrija un pēc tam molekulārā ģeometrija.
Seši blīvuma līmeņi
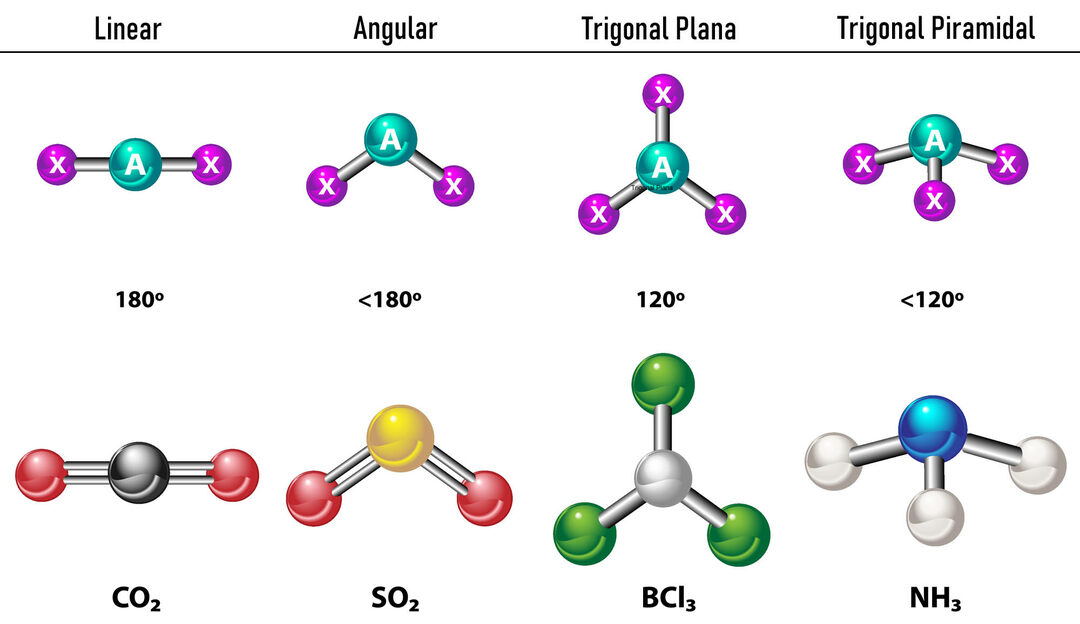
Gadījumā, ja ap centrālo atomu ir divi elektronu blīvumi, saites atradīsies tik tālu viena no otras starp tiem, tas ir, 180º viens no otra, un tāpēc to elektroniskā ģeometrija ir lineāra un molekulāri arī lineāra.
Gadījumā, ja ap centrālo atomu ir trīs elektronu blīvumi, ir divas iespējas: trīs saites vai divas saites un viens nesaistīts pāris. Ja ir trīs saites, elektroniskā ģeometrija ir Trigonāls dzīvoklis, ar 120º leņķiem starp saitēm, un molekulārajai ģeometrijai ir tāds pats nosaukums. Tagad, ja ir nesasaistīts pāris, viņi viens otru atgrūž ar vairāk intensitāte ka saistītie lādiņi tāpēc mēdz saspiest saites leņķus. Leņķis starp brīvo pāri un katru saiti ir 120º, un elektroniskā ģeometrija ir trigonāla plakne, bet molekulārā ģeometrija ir leņķiskā.
Gadījumā, ja ap centrālo atomu ir četri elektronu blīvumi, elektroniskā ģeometrija ir tetraedriska. Ja visi četri elektronu pāri ir saistīti, to molekulārā ģeometrija pēc nosaukuma sakrīt ar elektronisko ģeometriju un saites leņķis ir 109,5º. Tagad, ja viens no pāriem ir brīvs, saites leņķis kļūst mazāks (107º) un molekulārā ģeometrija ir tipiska Trigonālā piramīda. Visbeidzot, ja divi ir brīvi pāri un divi ir saistīti, saites leņķis ir 104,5º, bet molekulāro ģeometriju sauc Leņķisks.
Ja elektronu blīvums ap centrālo atomu ir pieci, to sauc par a Trigonālā bipiramīda tā elektroniskā ģeometrija. Ja visas slodzes ir savienotas, starp ekvatoriālajām saitēm ir 120ºC leņķi, bet starp aksiālajām un ekvatoriālajām saitēm ir 90º leņķi. Tagad molekulāro ģeometriju sauc arī par trigonālo bipiramīdu, savukārt, ja ir četri saistīti pāri un viens brīvs pāris, molekulārā ģeometrija ir izkropļota, veidojot labi zināmo.rokeris”, Tur ir nosaukums, ko tas iegūst Izkropļots tetraedrs. Savukārt, ja divi no pieciem elektronu pāriem ir brīvi un trīs no tiem ir saistīti, tam ir “T” formas ģeometrija un tā nosaukums ir tieši saistīts ar tā struktūru. Visbeidzot, ja tas ir pretējs, trīs brīvi pāri un divi saistīti lādiņi, molekulārā ģeometrija ir lineāra.
Visbeidzot, ap centrālo atomu ir seši elektronu blīvumi, un veidojas oktaedrs, tāpēc tā nosaukums elektroniskajā ģeometrijā. Līdzīgi molekulārā ģeometrija tiek nosaukta, ja visi tās pāri ir saistīti. Ja jums ir pieci saistīti pāri un viens brīvs pāris, molekulārā ģeometrija ir kvadrātveida bāzes piramīda. Ja jums ir četri saistīti pāri un divi brīvi pāri, molekulārā ģeometrija ir Kvadrātveida dzīvoklis.
Attēls: saldā daba
Molekulārās ģeometrijas tēmas