Ķīmiskā līdzsvara definīcija
Inhibīcija Stīgu Teorija / / April 02, 2023
1. Stabilitātes nosacījums atgriezeniskās reakcijās, kur tiešās un apgrieztās reakcijas ātrums vienmēr paliek nemainīgs.
kat. gramatiskā: vīriešu dzimtes lietvārds
zilbēs: e-qui-li-brio + quí-mi-co.
Ķīmiskais līdzsvars

Ķīmijas inženieris
Notiek reakcija līdzsvaru ķīmiska, kad reakcijas ātrums tiešais ir vienāds ar ātrumu apgrieztā reakcija. Visi ķīmiskā reakcija ir zināma spontanitāte uz līdzsvaru, un, lai to izpētītu, mēs to darām ar ∆G zīmi, Enerģija Gibbs free, kas nozīmē, ka, izmantojot šī lieluma vērtību, mēs varam paredzēt, vai reakcija notiks noteiktā virzienā vai nē.
Gibsa brīvās enerģijas izmaiņas parasti standarta apstākļos tiek izteiktas kā produktu un reaģentu enerģijas atšķirības arī standarta stāvoklī:
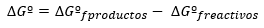
Ja reakcija notiek nestandarta apstākļos, attiecības starp ∆Gº un ∆G nosaka šādi izteiksme:
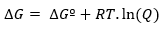
kur Q ir reakcijas koeficients.
Lai saprastu reakcijas ātruma un ķīmiskā līdzsvara ietekmi, mums ir jāizpēta ∆G zīme:
Ja ∆G ir negatīvs, tas nozīmē, ka reakcija ir spontāna (notiek) tiešā nozīmē.
Ja ∆G ir pozitīvs, tas nozīmē, ka reakcija nav spontāna (nenotiek) tiešā nozīmē.
Savukārt, ja ∆G=0, izmaiņu nebūs, jo sistēma ir līdzsvarā un, kā jau minēts, tiešās reakcijas ātrums ir vienāds ar netiešās reakcijas ātrumu. Tas nozīmē, ka reakcijas koeficients Q ir vienāds ar līdzsvara konstanti K, tāpēc nav tendence dot priekšroku konkrētam reakcijas virzienam.
Tā kā Q ir definēts kā:
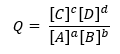
Vispārējai reakcijai:
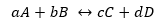
Kamēr K ir tāda pati forma, bet ar koncentrāciju līdzsvarā.
Ja mēs atgriežamies pie gadījuma, kad ∆G ir negatīvs, tas nozīmē, ka reakcijas koeficients Q ir mazāks par K (konstante no līdzsvars), nozīmē, ka produkta koncentrācija ir mazāka par to, kādai tai vajadzētu būt, ja notiek reakcija. līdzsvaru. Tāpēc spontanitātes ziņā tas kļūst spontāns tiešā nozīmē.
Tā kā, ja ∆G ir pozitīvs, pārsvarā būs produkti, kas pārsniedz to, kas būtu, ja sistēma būtu līdzsvarā, un Q būs lielāks par K. Tāpēc reakcija ir spontāna pretējā virzienā.
Jāatzīmē, ka stingra Q un K definīcija ir dota attiecībā uz produktu un reaģentu aktivitātēm, definējot aktivitāti koncentrācijas vai spiediena izteiksmē kā:
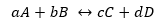
Nu labi:
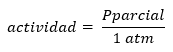
No tā izriet, ka gan Q, gan K ir bezizmēra, un tos var uzskatīt gan koncentrācijās, gan daļējā spiedienā.
Ja produktu un reaģentu koncentrācija vai daļējais spiediens laika gaitā paliek nemainīgs, rodas situācija ķīmiskais līdzsvars, savukārt dinamiska līdzsvara situācija tiek sasniegta, jo notiek tiešās un apgrieztās reakcijas ātrums ar identisks. Svarīgi izcelt līdzsvara dinamismu, ātrumu, ar kādu tie veidojas un patērē produktus un reaģentus ir vienādi, tāpēc koncentrācijas vai daļējais spiediens nav tas atšķiras.
Ja nosacījums attālinās no līdzsvara situācijas, noteiktas sugas dominēs pār citām, un no turienes rodas izteiksme, kas attiecas uz tiešās un apgrieztās reakcijas ātrumu Kc:
Pieņemsim, ka reakcija ir redzama iepriekš:
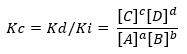
Tā kā reakcijas ātruma konstantes ir Kd un Ki, tās ir attiecīgi virzienā uz priekšu vai atpakaļ.
Atkal, ja Kc>1, tas nozīmē, ka Ki ir mazāks par Kd, tāpēc produkti ir ļoti pārveidojušies par reaģentiem. Šajā gadījumā līdzsvars tiek novirzīts uz produktiem.
Ja Kc<1 notiek pretējais, tas nozīmē, ka tiešās reakcijas ātrums ir mazāks par netiešās reakcijas ātrumu un ir mazs patēriņu reaģentu līdzsvars tiek novirzīts uz reaģentiem.
Savukārt, ja Kc=1, ātrumi ir vienādi un sistēma ir līdzsvarā.
Ir svarīgi definēt divus jautājumus: pirmkārt, šīs konstantes vērtība ir atkarīga tikai no temperatūra un, savukārt, mainās atkarībā no lieluma, ko izmanto, lai izteiktu produktu un reaģentu koncentrāciju vai spiedienu.
Visbeidzot, likumu Ķīmiskais līdzsvars pielāgojas atšķaidītiem šķīdumiem vai gāzēm zemā spiedienā.

