30 Alkoholu piemēri
Piemēri / / November 06, 2023
The spirti ir organiskie ķīmiskie savienojumi kuru struktūrā ir hidroksilfunkcionālā grupa (-OH), kas saistīta ar oglekli (-C). Grupu (-C – OH) sauc par “karbinolu”. Daži alkoholu piemēri ir: metanols, etanols un 1-propanols.
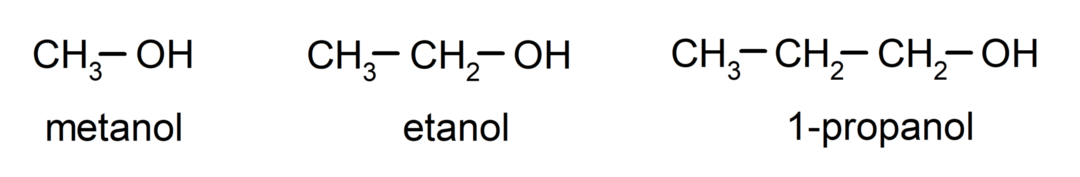
Alkoholi ir ķīmiski savienojumi ar dažādu pielietojumu ikdienas dzīvē, jo tiem piemīt antibakteriālas un antiseptiskas īpašības. No otras puses, tie var būt bīstami cilvēka veselībai, ja tiek uzņemti nekontrolēti.
Tāpat cilvēki nevar uzņemt visus spirtus.
- Skatīt arī: Amīni un ketoni
Alkoholu veidi
Atkarībā no oglekļa atomu skaita, pie kuriem ir piesaistīts oglekļa atoms, kuram ir pievienota hidroksilgrupa, spirts var būt:
- Primārais alkohols. Oglekļa atoms, kuram ir pievienota hidroksilgrupa, ir pievienots arī vienam oglekļa atomam. Piemēram:
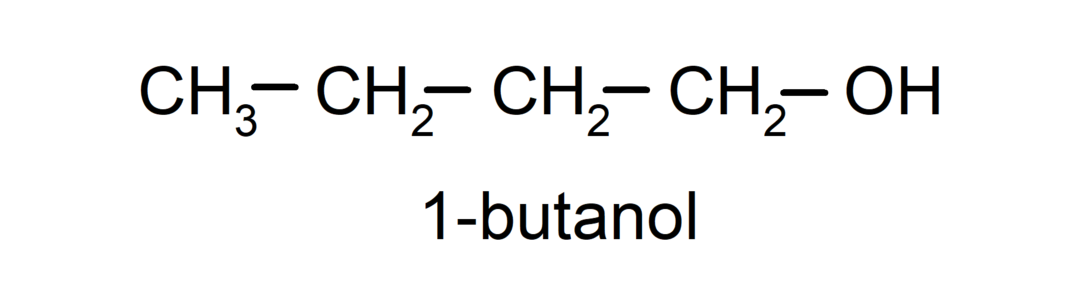
- Sekundārais alkohols. Oglekļa atoms, kuram ir pievienota hidroksilgrupa, ir saistīts arī ar diviem citiem oglekļa atomiem. Piemēram:
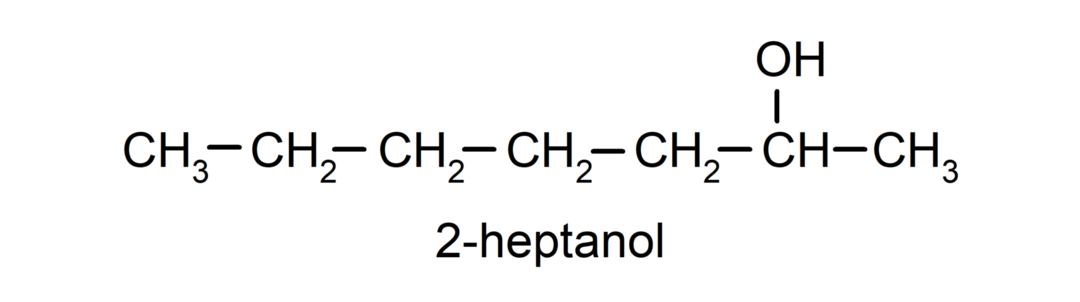
- Terciārais alkohols. Oglekļa atoms, kuram ir pievienota hidroksilgrupa, ir piesaistīts arī trim oglekļa atomiem. Piemēram:
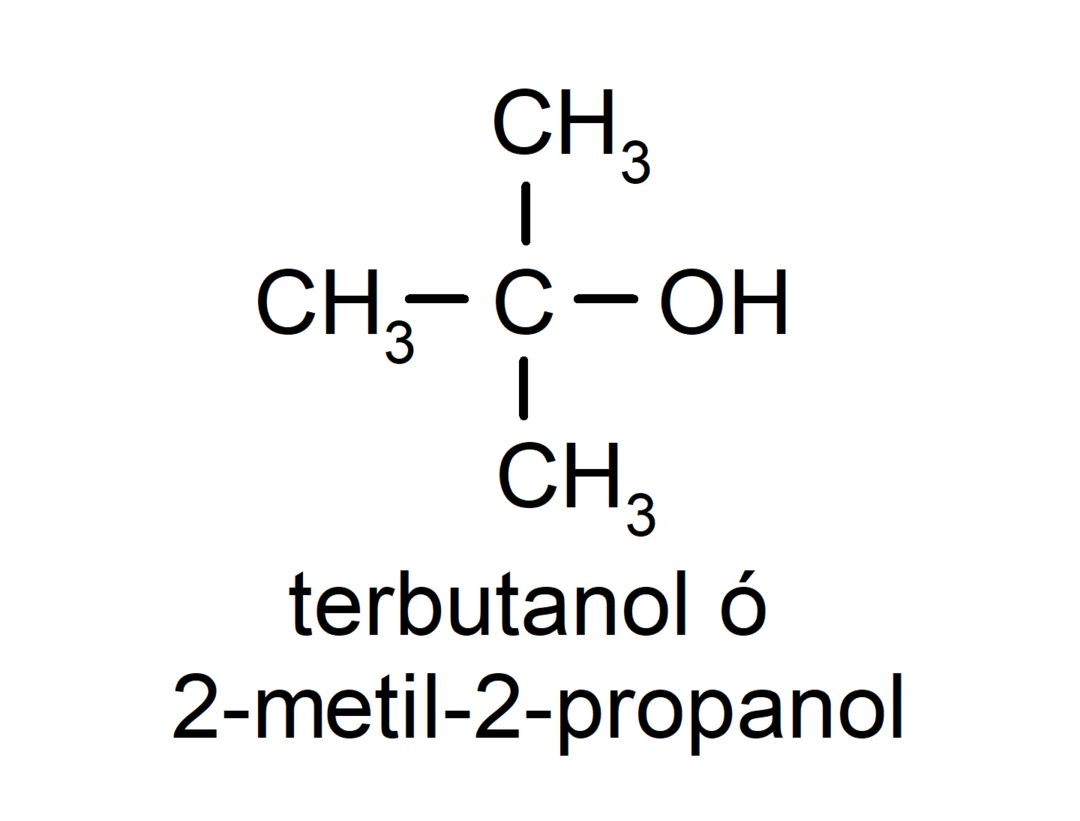
Atkarībā no tajā esošo hidroksilgrupu skaita spirts var būt:
- Diol. Tā struktūrā ir divas hidroksilgrupas. Piemēram:
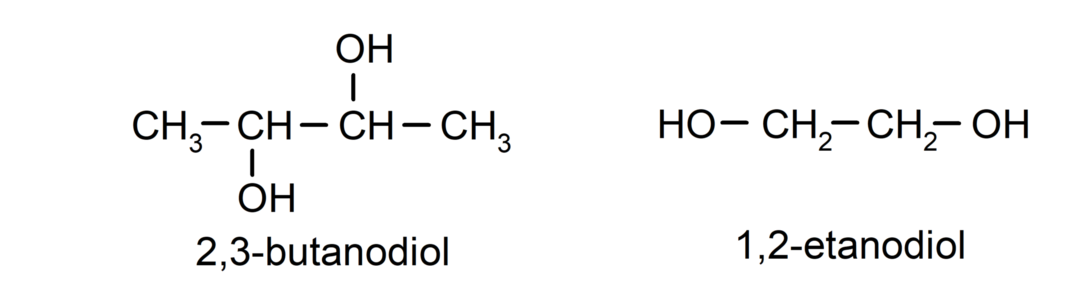
- Triol. Tā struktūrā ir trīs hidroksilgrupas. Piemēram:
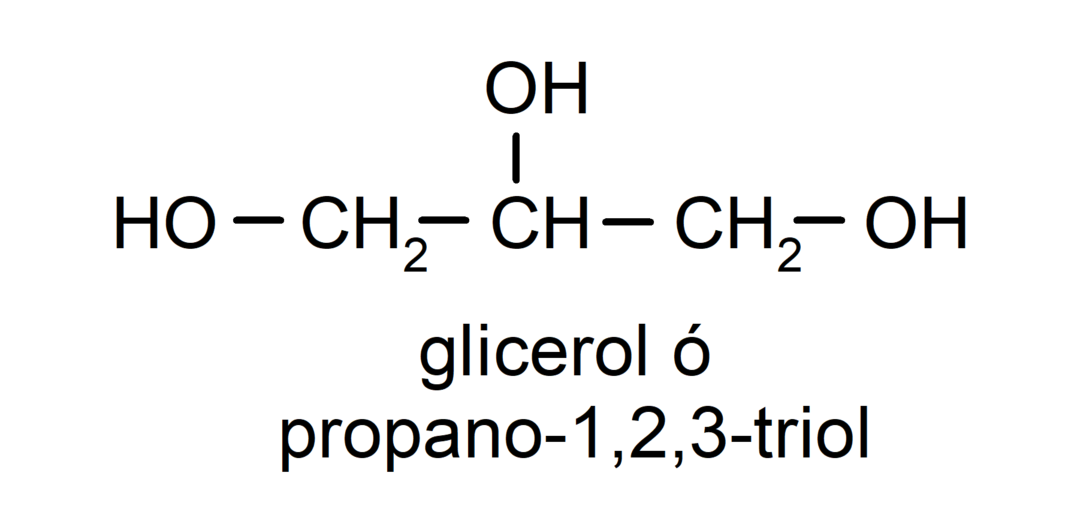
- Polialkohols. Tā struktūrā ir daudz hidroksilgrupu. Piemēram:
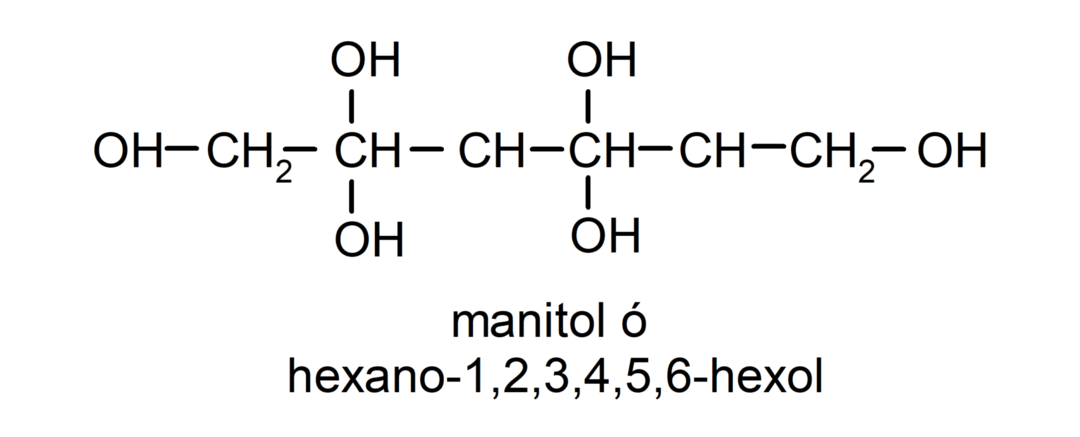
Spirtu fizikālās īpašības
Dažas no spirtu fizikālajām īpašībām ir:
- Vārīšanās punkts. Viršanas temperatūra spirtos ir diezgan augsta, jo tajā ir hidroksilgrupa, kas ļauj veidot ūdeņraža saites. Turklāt, jo vairāk hidroksilgrupu ir oglekļa ķēdē, jo augstāka ir Vārīšanās punkts no spirtiem.
- Polaritāte. Alkoholi ir diezgan polāri savienojumi.
- Šķīdība. Zemas molekulmasas spirti šķīst ūdenī. No otras puses, jo lielāka ir spirtu oglekļa ķēde, jo zemāka ir to šķīdība ūdenī. Turklāt, jo vairāk hidroksilgrupu ir spirtos, jo lielāka ir to šķīdība ūdenī.
- Apkopošanas stāvoklis. Lielākā daļa spirtu istabas temperatūrā (25ºC) ir šķidri un tiem piemīt raksturīga smaka.
Spirtu ķīmiskās īpašības
Dažas no spirtu ķīmiskajām īpašībām ir:
- Alkoholi uzvedas kā skābes un bāzes.. To kā skābju uzvedību var novērot reakcijās ar aktīviem metāliem, atbrīvojot ūdeņraža gāzi un veidojot alkoksīdus.

To kā bāzes uzvedību var redzēt tādās reakcijās kā metanola reakcija ar bromūdeņradi, veidojot metiloksonija bromīdu.
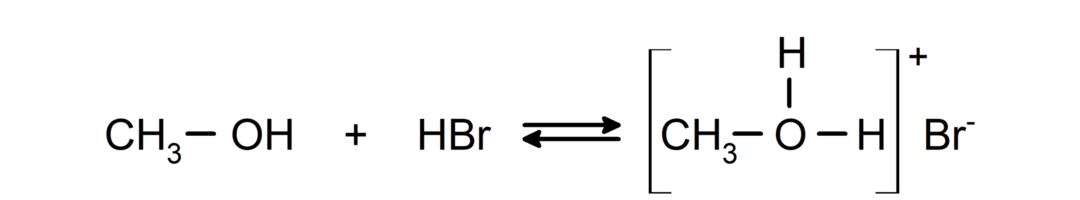
- Spirti tiek pakļauti halogenēšanas reakcijai. Tie reaģē ar ūdeņraža halogenīdiem, veidojot alkilhalogenīdus.
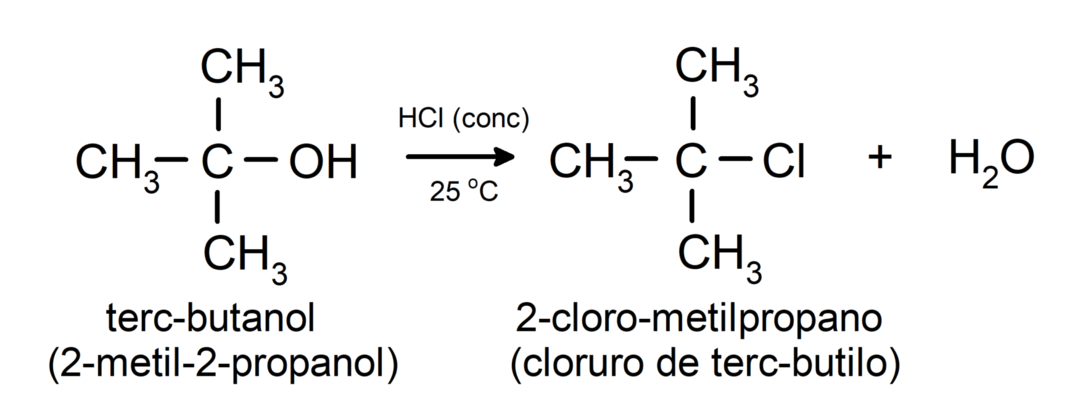
-
Alkoholi iziet oksidācijas reakcijas kad tie reaģē ar noteiktiem oksidējošiem savienojumiem. Oksidācijas reakciju produkti ir atkarīgi no reaģējošā spirta veida, tas ir, vai tas ir primārais, sekundārais vai terciārais.
Primārā spirta oksidēšana, veidojot aldehīdu vai karbonskābi.
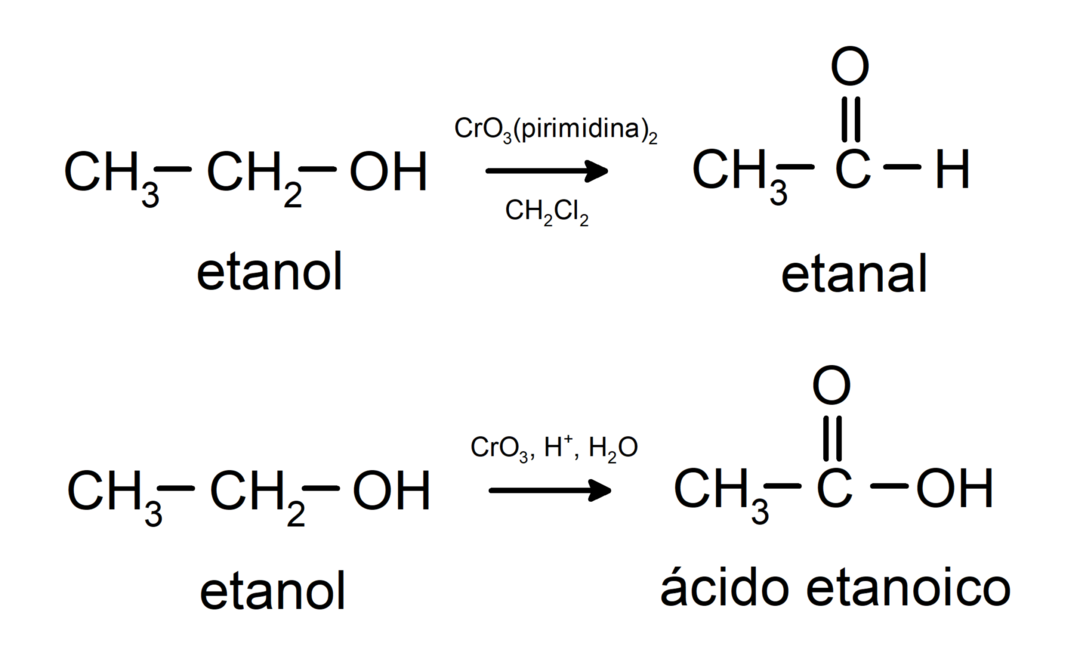
Sekundārā spirta oksidēšana, veidojot ketonu.
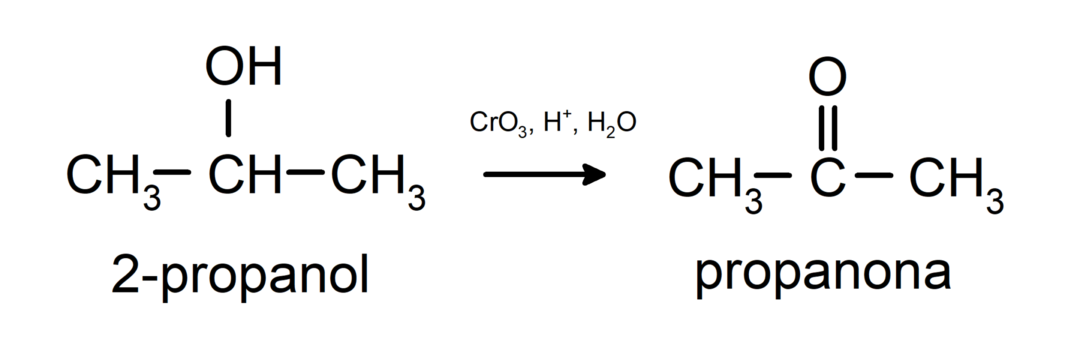
Terciārie spirti neoksidējas ar parastajiem oksidētājiem. Ar ļoti spēcīgiem oksidētājiem tos var pārveidot par alkēniem, kurus pēc tam var oksidēt.
Spirti, kuriem ir divas hidroksilgrupas, kas atrodas uz blakus esošajiem oglekļiem, tiek oksidēti ar svina tetraacetātu, veidojot divus ketonus.
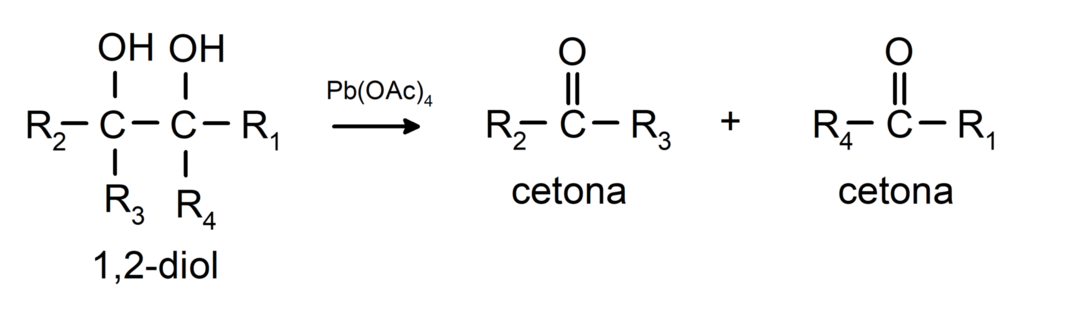
- Alkoholi tiek pakļauti dehidrogenēšanas reakcijai. Šīs reakcijas notiek tikai ar primārajiem un sekundārajiem spirtiem, kuri, pakļaujot tos augstām temperatūrām katalizatoru klātbūtnē, izdala ūdeņradi.
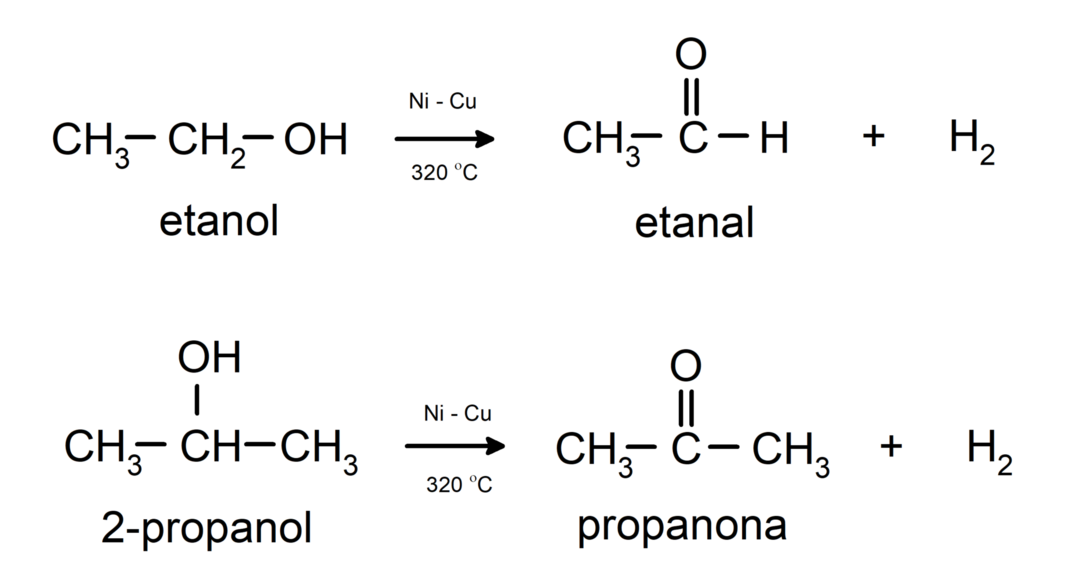
- Alkoholi tiek pakļauti dehidratācijas reakcijai. Spirti dehidrē, veidojot atbilstošus alkēnus. Šī reakcija notiek skābes un vidējās temperatūras klātbūtnē.
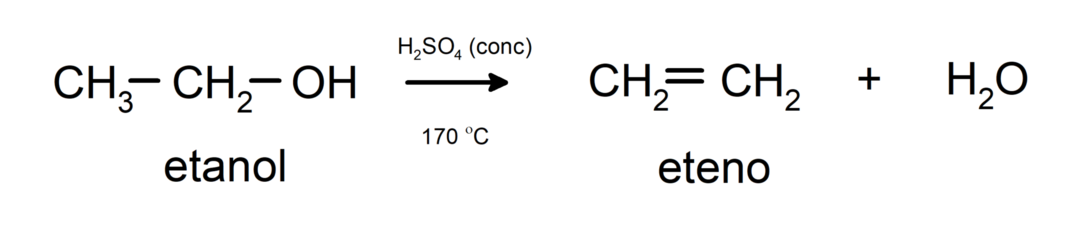
Alkohola nomenklatūra
Saskaņā ar IUPAC (Starptautiskā tīrās un lietišķās ķīmijas savienības) izveidoto nomenklatūru spirti tiek nosaukti pēc šādiem noteikumiem:
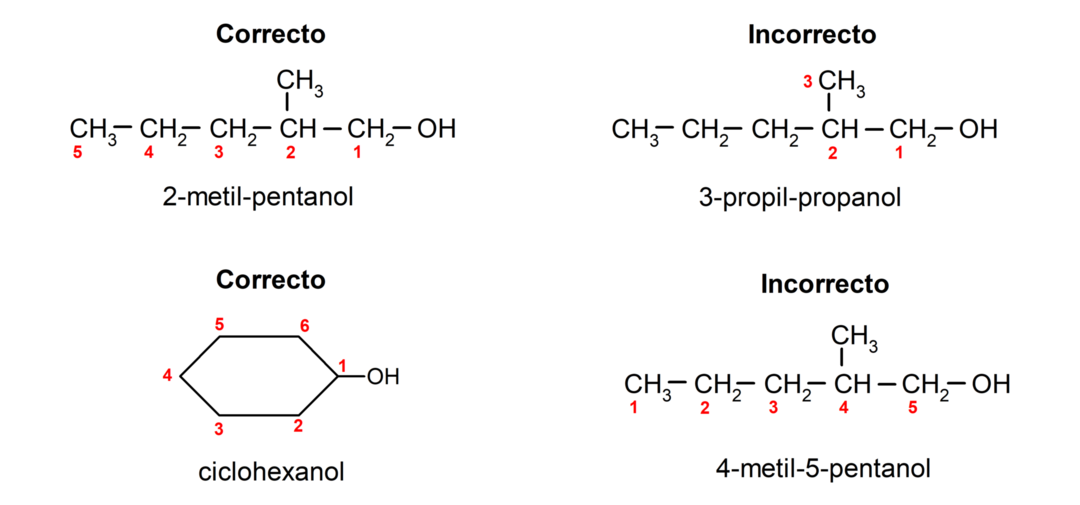
- Hidroksilgrupas pozīcija tiek izvēlēta, ņemot vērā to, ka tā ieņem mazāko iespējamo skaitu oglekļa ķēdē. Ja spirta struktūra ir cikliska, tiek ņemta vērā 1. pozīcija uz oglekļa, kurai ir pievienota hidroksilgrupa, un tās nosaukšanai tiek izmantots prefikss ciklo-.
- Alkohola nosaukumu raksta, izmantojot priedēkļus, kas norāda atomu skaitu oglekļa ķēdē, un papildus tiek ievietots piedēklis -ol.
- Ja spirta struktūrā ir zari, par galveno oglekļa ķēdi tiek izvēlēta garākā ķēde, kurā ir arī hidroksilgrupa.
Saskaņā ar tradicionālo nomenklatūru spirti tiek nosaukti, rakstot vārdu “alkohols” un pēc tam rakstot alkohola nosaukumu. alkāns, kas atbilst oglekļa ķēdei, bet tā vietā, lai izmantotu alkāna -ane galu, galu -ilisks.
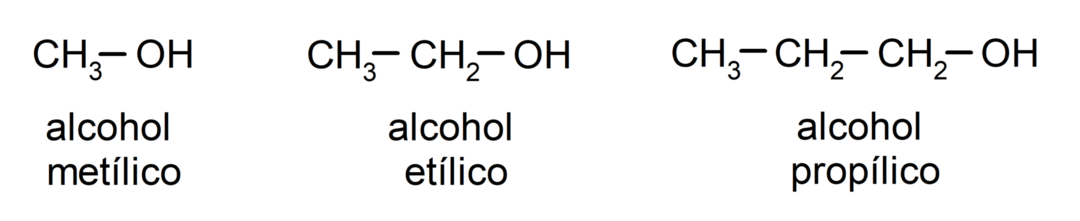
Alkoholu piemēri
- metanols
- etanols
- 1-propanols
- 2-propanols
- 1-butanols
- 3-etilheksān-2-ols
- glicerīns
- fenols
- 2-metil-2-butanols
- 1,2-etāndiols
- 1,5-heptadien-3-ols
- 3-metil-2-butanols
- benzilmetanols
- 3-pentanols
- 2-metilfenols
- 1,2-dihidroksifenols
- cikloheaksnols
- 1-feniletanols


Alkoholu lietošana
Visizplatītākie spirtu lietojumi ir:
- Tos izmanto kā dezinfekcijas līdzekļus un antiseptiskus līdzekļus, jo tie aptur dažu augšanu mikroorganismiem vai iznīcināt tos. Šim nolūkam visvairāk izmanto etanolu un izopropilspirtu.
- Tos izmanto dažādu sintēzē ķīmiskie savienojumi. Metanolu, piemēram, izmanto, lai iegūtu metanolu (formaldehīdu).
- Tos izmanto antifrīzu ražošanai. Metanols ir viens no visbiežāk izmantotajiem šim nolūkam.
- Tos izmanto kā šķīdinātājus farmācijas rūpniecībā. Etanols šajā ziņā ir viens no visvairāk izmantotajiem.
- Tos izmanto kā šķīdinātājus lakām, krāsvielām un tintēm. Šim nolūkam plaši izmanto metanolu.
- Tos izmanto kā degvielu, un ir būtiska tendence daļēji aizstāt to izmantošanu fosilais kurināmais izmantojot bioetanola degvielu.
- Tos izmanto sveķu izgatavošanai. Fenols tiek izmantots šajā nozīmē.
Alkohola lietošanas briesmas
Lai gan alkohola lietošana mūsdienās ir sabiedrībā pieņemta, šīs vielas pārmērīga lietošana rada atkarību un atkarību.
Etanols ir alkoholiskos dzērienos esošais spirts, kas, lietojot pārmērīgi daudz, ietekmē kognitīvās spējas, un var izraisīt sirds un asinsvadu slimības, aknu cirozi un vēzis.
Turklāt, sasniedzot alkohola reibuma pakāpi, tas ir, dzēruma stāvokli, ja ir pārāk daudz alkohola, var iestāties alkoholiskā koma, kas var izraisīt elpošanas paralīzi un pat nāvi. nāvi.
Atsauces
- T. UZ. Geissman. (1974) “Organiskās ķīmijas principi” Otrais izdevums. Redakcija Reverté, S.A. ISBN: 8429171800
- Ahumada-Kortess, Dž. G., Gamess-Medina, M. E. un Valdess-Montero, K. (2017). Alkohola lietošana kā sabiedrības veselības problēma. Ra Ximhai, 13(2), 13-24.
- Morisons, R. T. un Boids, R. N. (1998). Organiskā ķīmija. Pīrsona izglītība.
- Vainingers, S. J. un Stermits, F. R. (1988). Organiskā ķīmija. Es apgriezos otrādi.
Sekojiet līdzi:
- Etilspirts
- Degvielas
- organiskā ķīmija
