30 Binārās pārdošanas piemēri
Piemēri / / November 09, 2023
The binārie sāļi (neitrālie sāļi) veidojas, apvienojot metālu un nemetālu. Ir ķīmiskie savienojumi sastāv tikai no diviem ķīmiskie elementi. Piemēram: nātrija hlorīds (NaCl) un kālija bromīds (KBr).
- Skatīt arī: Metāli un nemetāli
Bināro sāļu piemēri
- Nātrija hlorīds (NaCl)
- Dzelzs (II) hlorīds (FeCl2)
- Dzelzs (III) hlorīds (FeCl3)
- Kobalta(II) sulfīds (CoS)
- Kobalta (III) sulfīds (Co2Jā3)
- Svina (II) sulfīds (PbS)
- Svina (IV) sulfīds (PbS2)
- Kalcija hlorīds (CaCl2)
- Nātrija fluorīds (NaF)
- Litija hlorīds (LiCl)
- Stroncija hlorīds (SrCl2)
- Bārija hlorīds (BaCl2)
- Alumīnija hlorīds (AlCl3)
- Magnija sulfīds (MgS)
- Rubidija hlorīds (RbCl)
- Kalcija bromīds (CaBr2)
- Kālija sulfīds (K2S)
- Magnija bromīds (MgBr2)
- Cinka sulfīds (Zn2S)
- Litija bromīds (LiBr)
- Niķeļa hlorīds (NiCl2)
- Urāna(III) hlorīds (UCl3)
- Sudraba bromīds (AgBr)
- Sudraba jodīds (AgI)
- Kālija bromīds (KBr)
Bināro sāļu nomenklatūra
Saskaņā ar tradicionālo nomenklatūru bināros sāļus nosauc, rakstot nemetāliskā elementa nosaukumu ar galotni -ide. No otras puses, metāla elementa nosaukumu raksta atbilstoši tā oksidācijas pakāpei:
- Zemākajam oksidācijas līmenim tas tiek rakstīts ar galotni -oso. Piemēram: dzelzs hlorīds (FeCl2), kur dzelzs oksidācijas pakāpe ir 2+.
- Augstākajam oksidācijas līmenim tas tiek rakstīts ar galotni -ico. Piemēram: dzelzs hlorīds (FeCl3), kur dzelzs oksidācijas pakāpe ir 3+.
Saskaņā ar sistemātisko nomenklatūru bināros sāļus nosauc, rakstot nemetāliskā elementa nosaukumu ar prefiksu, kas norāda atomi no šī elementa savienojumā. Turklāt nemetāliskā elementa nosaukumā tiek ievietota galotne -uro. Pēc tam tiek ievietots metāla elementa nosaukums. Piemēram: magnija dihlorīds (MgCl2) un dzelzs trihlorīds (FeCl3).
Saskaņā ar Stoka nomenklatūru binārie sāļi tiek nosaukti, rakstot nemetāliskā elementa nosaukumu ar galotni -ide. Pēc tam tiek ievietots metāla elementa nosaukums, kam seko tā oksidācijas pakāpe, kas rakstīta ar romiešu cipariem un iekavās. Piemēram: dzelzs (II) hlorīds (FeCl2) un kobalta (III) sulfīds (Co2Jā3).
Bināro sāļu pielietojumi
- Tos izmanto kā aukstumaģentus pārtikas un farmācijas rūpniecībā. Piemēram: kalcija hlorīds (CaCl2).
- Tos izmanto metāla virsmu apstrādei pret koroziju. Piemēram: nātrija fluorīds (NaF).
- Tos izmanto mitruma regulēšanai papīra un būvniecības nozarē. Piemēram: kalcija hlorīds (CaCl2).
- Tos izmanto stikla rūpniecībā, lai likvidētu piemaisījumus. Piemēram: silīcija tetrahlorīds (SiCl4).
- Tos izmanto kā ēdiena gatavošanas sastāvdaļas. Piemēram: nātrija hlorīds (NaCl).
Bināro sāļu fizikālās īpašības
- Tiem ir augsts kušanas punkts, jo tie sastāv no jonu saites.
- Izšķīduši vai izkausēti tie vada elektrisko strāvu.
- Visbiežāk sastopamajiem sāļiem ir zema cietība.
- Tie nav saspiežami.
- Lielākā daļa var izšķīst ūdenī.
Kā iegūst bināros sāļus?
Bināros sāļus var iegūt, izmantojot dažas no šīm ķīmiskajām reakcijām:
Reakcija starp metālu un nemetālu. Piemēram: reakcija starp nātriju (Na) un dihlorīdu (Cl2) ražo nātrija hlorīdu (NaCl).
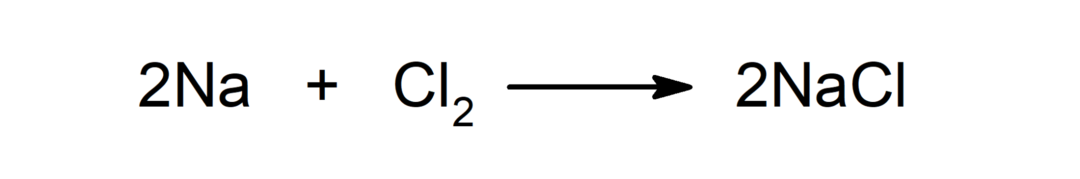
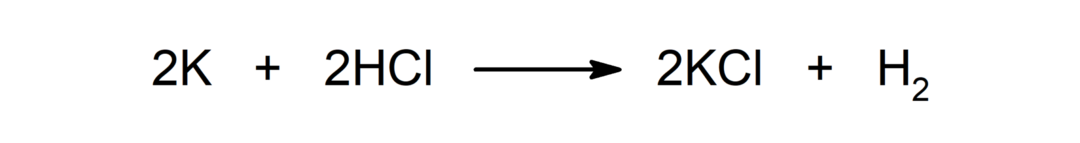
Reakcija starp metālu un skābi. Piemēram: Reakcijā starp kāliju (K) un sālsskābi (HCl) rodas kālija hlorīds (KCl) un dihidrogēns (H).2).
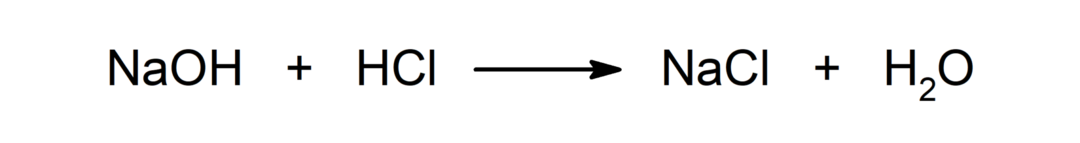
Reakcija starp skābi un bāzi. Piemēram: Reakcijā starp sālsskābi (HCl) un nātrija hidroksīdu (NaOH) veidojas nātrija hlorīds (NaCl) un ūdens (H).2ARĪ).
Sekojiet līdzi:
- oksisāļi
- neitrālie sāļi
- skābie sāļi
Atsauces
- Serons Villalba, A., Novoa Ramíress, K. S. un Alpizars Huaress, E. (2020). Nomenklatūras video 1: binārie sāļi un ķīmiskā reakcija.
- Akūrio Āriass, M. V. un Delgado Mendezs, M. UN. (2022). Uz spēlēm balstītas mācīšanās rokasgrāmata "binārajiem savienojumiem" vidusskolas ķīmijā "Herlindas Torālas" izglītības nodaļā (bakalaura darbs, Nacionālā izglītības universitāte).
- Kabrera, M. Dž. H. (2005). Pētījums par bināro un trīskāršo savienojumu elektronisko un strukturālo īpašību pirmajiem principiem (Doktora disertācija, La Lagunas Universitāte).

