Endotermisko reakciju piemēri
Piemēri / / November 09, 2023
A endotermiska reakcija Tā ir reakcija, kas absorbē enerģiju no vides siltuma veidā. Šajās reakcijās, lai reaģenti pārvērstos produktos, tiem ir nepieciešams absorbēt siltumu, kā rezultātā produktiem ir lielāka enerģija nekā reaģentiem, kas tos radīja. Daži endotermisko reakciju piemēri ir: fotosintēze un ūdens elektrolīze.
- Skatīt arī: Ķīmiskās reakcijas
Endotermisko reakciju piemēri ikdienas dzīvē
Dažas no galvenajām endotermiskajām reakcijām ir:
Ozona veidošanās atmosfērā. Ozons veidojas atmosfērā, kad molekulārais skābeklis (O2) absorbē ultravioleto starojumu un sadalās. Tad skābekļa atoms (O) var mijiedarboties ar citu skābekļa molekulu (O2) un veido ozonu (O3).

Ūdens elektrolīze. Tas ir process, kurā tas tiek piemērots Elektroenerģija ūdenim, lai to sadalītu divās daļās — ūdeņradī (H) un skābeklī (O).
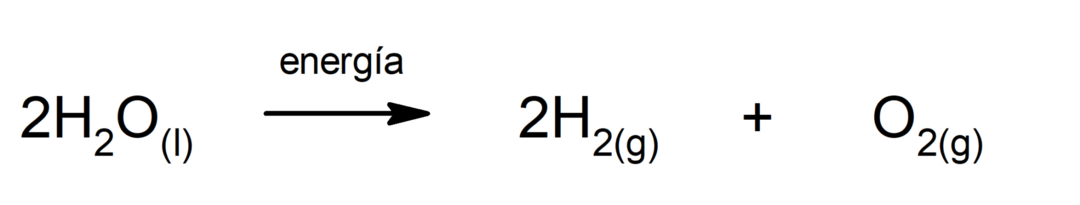
Fotosintēze. Tā ir ķīmiska reakcija, kuras rezultātā tiek absorbēts saules enerģija, oglekļa dioksīds (CO2) tiek pārveidots par glikozi. Šī reakcija ir galvenais augu uztura ceļš.
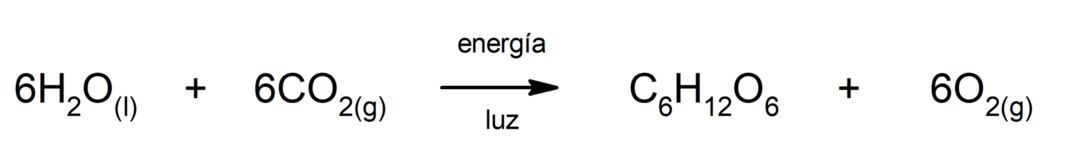
Dzelzs(II) sulfīda ražošana
. Lai notiktu reakcija starp sēru un dzelzi, ir nepieciešams nodrošināt enerģiju siltuma veidā.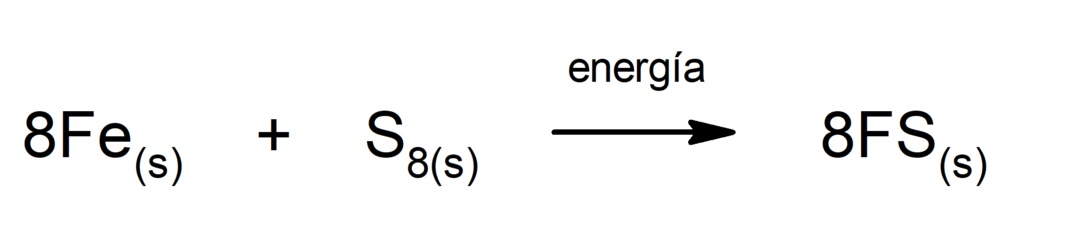
Oglekļa dioksīda sadalīšanās (CO2). CO sadalīšanās2 Augstās temperatūrās tas ražo oglekļa monoksīdu (CO) un skābekli (O2).
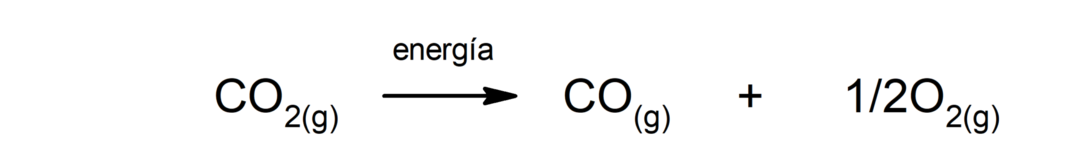
Kalcija karbonāta (CaCO3). Kalcija karbonāts sadalās, absorbējot siltumu, veidojot kalcija oksīdu (CaO) un oglekļa dioksīdu (CO)2).
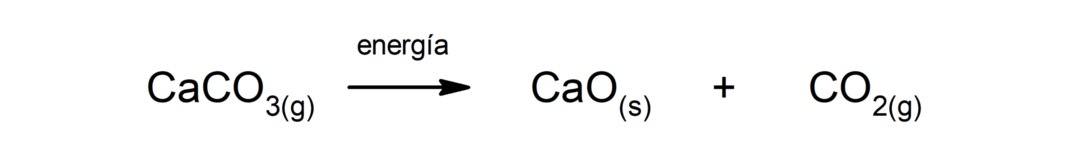
Atšķirība starp endotermisko un eksotermisko reakciju
Galvenā atšķirība starp endotermiskajām un eksotermiskajām reakcijām ir tāda, ka endotermiskās reakcijas absorbē siltumu, bet eksotermiskās reakcijas atbrīvo siltumu.
Turklāt endotermiskām reakcijām ir raksturīga entalpijas palielināšanās, savukārt eksotermiskās reakcijas ir saistītas ar entalpijas samazināšanos.
Entalpija ir termodinamisks lielums, kas nosaka siltumenerģijas plūsmu nemainīgā spiedienā ķīmiskās reakcijas laikā. To apzīmē ar burtu H, un tā variācija ir viens no galvenajiem rādītājiem, lai noteiktu, vai ķīmiskā reakcija ir endotermiska vai eksotermiska.
- Ja ķīmiskās reakcijas entalpijas izmaiņas ir lielākas par nulli (ΔH > 0) ir endotermisks.
- Ja ķīmiskās reakcijas entalpijas izmaiņas ir mazākas par nulli (ΔH < 0) ir eksotermisks.
Sekojiet līdzi:
- Fizikāli ķīmiskās parādības
- Ķīmija ikdienas dzīvē
- Ķīmija ikdienas dzīvē
- Organiskā un neorganiskā ķīmija
Atsauces
- Soto-Kordova, S. (2016). Endotermiskās reakcijas. Tehnoloģiju krātuve Kostarikas Tehnoloģiskais institūts.
- Korominass, Dž. (2017). Ikdienas dzīves ķīmiskās reakcijas. Alembic, (90), 8.-26.
- Sančess, M. T. M. un Sančess, M. M. (2002). Eksperimentāls endotermisko reakciju pētījums ESO studentiem. RSEQ ķīmijas gadagrāmatas, (4), 36-39.

