Daltona likuma piemērs
Ķīmija / / July 04, 2021
Angļu zinātnieks Džons Daltons (1766-1844) bija fiziķis un ķīmiķis, kurš daudz veicināja elementu un ķīmisko vielu saspiešanu un klasifikāciju. Starp viņa galvenajiem ieguldījumiem ir pirmais atomu un savienojumu attēlojuma modelis, izmantojot grafisko attēlojumu. Viņš arī formulēja tā saukto "Vairāku proporciju likumu", kas pazīstams arī kā Daltona likums.
Attiecībā uz ķīmiskajām kombinācijām Luijs Prusts (1754-1826) formulēja "Nemainīgu proporciju likumu", kurā viņš apkopo novērojums, ka ķīmiskās vielas vienmēr apvienojas vienā un tajā pašā proporcijā, lai iegūtu tos pašus savienojumus. Tas ir, ja ūdeņradis un skābeklis tiek apvienoti, tie vienmēr apvienosies vienādās proporcijās, lai iegūtu ūdeni. Tomēr šis likums nepaskaidroja, kā pastāv dažādi savienojumi, kas sastāv no vienām un tām pašām vielām.
Ar savu atomu teoriju Daltons saprata, ka, apvienojot dažas vienkāršas vielas, tās var tiek ražoti dažādi savienojumi un vienas vielas daudzums mainās proporcionālā proporcijā vienkārši.
Daltona likums ir teikts šādi:
Elementa svars, kas savienojas ar tādu pašu daudzumu cita, veidojot dažādus ķīmiskos savienojumus, mainās atkarībā no ļoti vienkāršas attiecības.Tas nozīmē, ka, ja mēs zinām, kā vielas tiek apvienotas vienkāršās proporcijās, un vienas vielas daudzums paliek nemainīgs un citas vielu mēs ievietojam vienkāršā proporcijā kā attiecība 2, 3 vai 4 attiecībā pret sākotnējo proporciju, katrā gadījumā mēs iegūsim vielu savādāk. Tas notiek, piemēram, kombinējot fosforu, ūdeņradi un skābekli.
Ja mēs apvienosim 1 tilpumu fosfora, 3 tilpumus ūdeņraža un 2 tilpumus skābekļa, mēs iegūsim hipofosforskābi:
P + 3H + 2O -> PO2H3
Ja iepriekšējā reakcijā mēs mainām tikai skābekli vienkāršā proporcijā 2, mēs iegūsim fosforskābi:
P + 3H + 4O -> PO4H3
Jāņem vērā, ka šajā laikā atomu valences jēdziens vēl nebija zināms, tātad nebija precīzi zināms, kāpēc dažas vielas var kombinēt mainīgās proporcijās un citas nē.
Daltona likuma piemērs
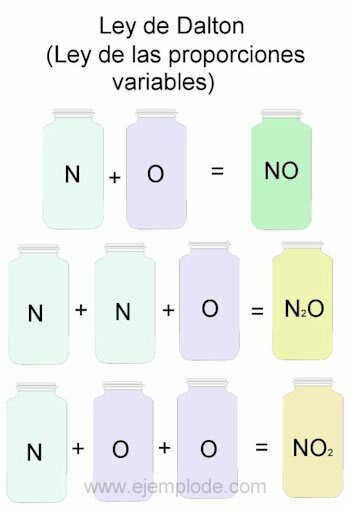
Lai parādītu Daltona likuma piemēru, par atsauci ņemsim slāpekļa (N) un skābekļa (O) kombinācijas.
Apvienojot tos vienā proporcijā, tas ir, pa vienam, mēs iegūsim slāpekļa oksīdu:
N + O -> NĒ
Ja mēs uzturēsim slāpekļa tilpumu nemainīgu un mainīsim skābekli par 2, mēs iegūsim slāpekļa peroksīdu:
N + 2O -> NĒ2
Ja, pamatojoties uz slāpekļa oksīdu, mēs tagad uzturēsim skābekli nemainīgu un mainīsim slāpekļa tilpumu par 2, mēs iegūsim slāpekļa oksīdu:
2N + O -> N2VAI
Ja raksts jums bija noderīgs, neaizmirstiet dot mums +1.
