Ķīmiskās enerģijas piemērs
Ķīmija / / July 04, 2021
The Ķīmiskā enerģija ir tā, kas nāk no ķīmiskām reakcijām. Mijiedarbība starp ķīmiskajām sugām rada sašķelšanos un / vai saišu veidošanos, kas nozīmē attiecīgi enerģijas izdalīšanos vai absorbciju. Ķīmisko enerģiju sauc par atbrīvoto enerģiju, kuru var izmantot, piemēram, kā siltumenerģiju un elektrisko enerģiju.
Enerģija ķīmiskajās reakcijās
Ķīmisko enerģiju maksimālā izteiksmē var iegūt no diviem galvenajiem avotiem: sadedzināšanas un elektrolītiskajiem šķīdumiem. No otras puses, cilvēka ķermeņa līmenī ir iespējams iegūt enerģiju, ķīmiski sadaloties pārtikā.
Sadegšanas enerģija
Piemēram, kad degvielas metāns CH4, vienkāršākais ogļūdeņradis, sāk degt skābekļa oksidētāja klātbūtnē, tas sadalīsies, veidojot oglekļa dioksīda CO produktus.2 un ūdens H2VAI Turklāt, pārtraucot ūdeņraža atomu saites ar oglekļa atomiem, siltuma veidā tiks atbrīvota enerģija.
CH4 g) + 2O2 (g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 Kcal / mol
Metāna sadegšanas vienādojums. Šīs reakcijas siltumu attēlo ΔH. Negatīvā zīme norāda uz enerģijas izdalīšanos. Reakcija ir eksotermiska.
 Metāna gāzes sadedzināšana. Reakcija izpaužas ar liesmu.
Metāna gāzes sadedzināšana. Reakcija izpaužas ar liesmu.
Organisko savienojumu sadegšanas karstuma piemēri 25 ° C temperatūrā.
Savienojums |
Formula |
ΔH (Kcal / mol) |
Metāns (g) |
CH4 |
-212.80 |
Etāns (g) |
C2H6 |
-372.82 |
Propāns (g) |
C3H8 |
-530.60 |
n-butāns (g) |
C4H10 |
-687.98 |
n-Pentāns (g) |
C5H12 |
-845.16 |
Etilēns (g) |
C2H4 |
-337.23 |
Acetilēns (g) |
C2H2 |
-310.62 |
Benzols (g) |
C6H6 |
-787.20 |
Benzols (l) |
C6H6 |
-780.98 |
Toluols (l) |
C7H8 |
-934.50 |
Naftalīns (-i) |
C10H8 |
-1,228.18 |
Saharoze (s) |
C12H22VAI11 |
-1,348.90 |
Metanols (l) |
CH3Ak |
-173.67 |
Etanols (l) |
C2H5Ak |
-326.70 |
Etiķskābe (l) |
CH3COOH |
-208.34 |
Benzoskābe (s) |
C6H5COOH |
-771.20 |
Lai degviela nodrošinātu visu iespējamo sadegšanas siltumu, tai jābūt gāzveida stāvoklī. Kā redzams tabulā, šķidrais benzols veicina degšanas siltumu, kas ir par 6,22 Kcal / mol mazāks nekā gāzveida benzols. Tas nozīmē, ka jāmaina 6,22 Kcal / mol, lai veiktu pāreju no šķidruma uz gāzi.
Noklikšķiniet, lai iegūtu vairāk informācijas par Degvielas.
Elektrolītisko risinājumu enerģija
Elektrolītiskais vadītājs ir vide, kurā ir iesaistīta viena vai vairākas jonu sugas, kas ir izkliedēts ar tā elektrisko lādiņu, ļaujot tam iziet elektrisko strāvu Konstitūcija. Elektrolītiskie risinājumi ir elektrolītiskie vadītāji.
Elektrolītiskie vadītāji papildus elektrolītu šķīdumiem ietver arī Izkausēti sāļi, kā arī daži cietie sāļi, piemēram, nātrija hlorīds NaCl un sudraba nitrāts AgNO3.
Elektronu pārnese notiek ar pozitīvu un negatīvu jonu migrāciju uz elektrodiem. Šī migrācija ietver ne tikai elektrības nodošanu, bet arī vielas transportēšanu no vienas vadītāja daļas uz otru.
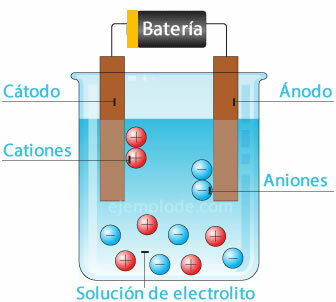 Elektroķīmiskais elements
Elektroķīmiskais elements
Potenciālā avota pievienošana metāla elektrodiem (katodam un anodam) un to iegremdēšana a Ūdens šķīdums, elektroni pārvietosies caur anodu, lai izkļūtu no šķīduma uz pozitīvo polu strūklaka. Tas notiek, piemēram, ar hlorīda jonu, kas izdalās no tā elektrona, un jau ar neitrālu lādiņu tas pievienojas citam hlora atomam, veidojot diatomisko molekulu. No šķīduma izdalīsies hlora gāze.
2Cl- = 2Cl + 2e-
Elektroni, kas atstāj avota negatīvo polu, tiks ievietoti iegremdētajā katodā. Sugas, kas atrodas ūdens šķīdumā (joni), paņems elektronus no katoda. Piemēram, ūdeņraža joni, kas veido ūdeni, ir bijuši pozitīvā lādiņā elektrons, kas neitralizējams un savienots ar citu ūdeņraža atomu, lai izveidotu molekulu diatomisks. Tas izkļūs no šķīduma kā ūdeņraža gāze.
2H+ + 2e- = 2H
2H = H2 g)
Šī elektronu apmaiņa var atbalstīt automašīnas akumulatoru darbību, kas sastāv no svina Pb elektrodiem, kas iegremdēti sērskābes H šķīdumā.2DR4.
Šī pati enerģija tiek iegūta visu veidu akumulatoros, kas tiek apstrādāti sadzīves līmenī: 9V, AA, AAA, D, nosaucot dažus piemērus.
Pārtikas enerģija
Cilvēki asimilē enerģiju, kas izdalās, sadalot pārtiku, ko mēs ēdam, mūsu ķermenī. Šī enerģija ir tā, ko mūsu ķermenis izmanto neapzinātām funkcijām (gremošanai, sirdsdarbībai, šūnu funkcijām) un tām, kuras mēs veicam.
Kamēr jums nav intensīvas fiziskās aktivitātes un vielmaiņa ir lēna, ieteicams regulāri uzņemt kalorijas, jo pārtikas produkti ar augstu Sarežģītākus lipīdus un ogļhidrātus, kuriem ir ļoti lielas struktūras, ir grūtāk noārdīt, kā rezultātā tas mainās Enerģija. Tādā gadījumā efekts būtu momentāni pretējs.
Augļus ieteicams lietot tad, kad jāstrādā naktī, jo augļi satur fruktozi, vienkāršs ogļhidrāts, kuru ir viegli noārdīt un kura enerģija mums būs pieejama pēc jūsu patēriņš.
Ķīmiskā enerģija un tās pārveidojumi
Termoelektriskās iekārtas
Smago kurināmo izmanto termoelektrostacijās, lai tiem būtu augsta un ilgstoša siltumspēja. Parasti tā ir mazuts (mazuts). Sadegšana, kas ir procesa ķīmiskais posms, kalpos kā apkures līdzeklis katlam, kas radīs piesātinātu tvaiku. Šis tvaiks iznāks zem spiediena caur tvaika sadales tīklu un sāks kustināt ģeneratora turbīnas. Šīs ierīces ražos elektroenerģiju, lai nodrošinātu atbilstošo iedzīvotāju skaitu.
Ķīmiskā enerģija → Mehāniskā enerģija → Elektriskā enerģija
Automobiļu darbība
Automašīnas ir atkarīgas no enerģijas avota, kas ir Akumulators. Akumulatorā jau ir zināms, ka notiek elektrolītiskā vadīšana, kas darbina aizdedzes sistēmu, domuzīmes piederumus un papildu strāvas kontaktligzdas. Pateicoties šai pieejamai elektrībai, automašīna varēs pārvietoties, lai aizvestu vadītāju vēlamajā vietā.
Ķīmiskā enerģija → Elektroenerģija → Mehāniskā enerģija