Kovalentās obligācijas piemērs
Ķīmija / / July 04, 2021
The Kovalentā saite ir tā, kurā divi atomi apvienojas, daloties savos elektronos, lai pabeigtu Okteta noteikumus.
Kovalentās obligācijas vēsture
Tieši 20. gadsimta sākumā ķīmiķi sāka saprast, kā un kāpēc veidojas molekulas. Pirmais nozīmīgais sasniegums nāca ar Žilberts Lūiss par ko ķīmiskās saites veidošanās tas nozīmē atomi dala elektronus. Lūiss raksturoja ķīmiskās saites veidošanos ūdeņradī kā:
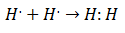
Šis elektronu savienošanas veids ir kovalentās saites, saites, kurā divus elektronus dala divi atomi. The Kovalenti savienojumi Viņi ir tādi satur tikai kovalentās saites.
Elektroni kovalentajā saitē
Vienkāršības labad dalīts elektronu pāris bieži tiek attēlots kā viena līnija savienojot elementu simbolus. Tādējādi ūdeņraža molekulas kovalentā saite tiek uzrakstīta kā H-H.
Kovalentajā saitē katrs dalītā pāra elektrons piesaista abu atomu kodoli. Šī pievilcība satur abus H molekulas atomus kopā.2 un tā ir atbildīga par kovalento saišu veidošanos citās molekulās.
Kovalentās saitēs starp vairāku elektronu atomiem
piedalās tikai valences elektroni, kas ir vistālāk, seklākajā orbītā. No viena līdz trīs no viņiem piedalīsies savienībā.Tiek saukti pārējie elektroni, kas nepiedalās saitē Neiesaistošie elektronivai ja mēs tos sakārtojam pa pāriem, Bezmaksas pāri. Tas ir, Valensijas elektronu pāri, kas nepiedalieties kovalentās obligācijas veidošanā.
Kovalentā obligāciju pārstāvniecība
Struktūras, ar kurām tiek attēloti kovalenti savienojumi, piemēram, H2 un F2 ir pazīstami kā Lūisa struktūras. Lūisa struktūra ir a kovalentās saites attēlojums, kur kopīgu elektronu pāris kas apzīmētas ar līnijām vai punktu pāriem starp diviem atomiem, un nedalītie brīvie pāri tiek norādīti kā punktu pāri uz atsevišķiem atomiem. Lūisa struktūrā ir parādīti tikai valences elektroni, nevis iekšējie.
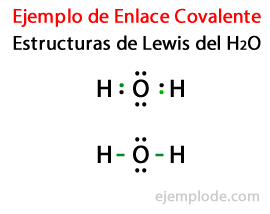
Ņemot vērā ūdens molekulas H Luisa struktūru2Vai arī visi ūdeņraža un skābekļa atomu valences elektroni vispirms ir atzīmēti ar punktiem.
Otrajā gadījumā saite tiek atzīmēta ar līniju. Un brīvie pāri, kas pastāvēs tikai skābeklī, ar punktiem.
Okteta noteikums
Šo molekulu, tāpat kā ūdens H, veidošanās2Vai arī ilustrējiet zvanu Okteta likums, ko ierosināja Luiss: Atoms, kas nav ūdeņradis, mēdz veidot saites, līdz tas sevi ieskauj astoņi valences elektroniTas ir, kovalentā saite veidojas, ja katram atsevišķam atomam nav pietiekami daudz elektronu, lai pabeigtu tā oktetu.
Dalot elektronus kovalentā saitē, katrs atoms pabeidz savu oktetu. Attiecībā uz ūdeņradi ir prasība iegūt hēlija elektronisko konfigurāciju, kurā kopā jābūt diviem elektroniem.
Okteta likums darbojas galvenokārt periodiskās tabulas otrā perioda vai rindas elementiem. Šiem elementiem ir apakšlīmeņi, kuros kopā var būt astoņi elektroni.
Kad šo elementu atoms veido kovalentu savienojumu, tas iegūst neona cēlgāzes elektronisko konfigurāciju, dalot elektronus ar citiem tā paša savienojuma atomiem.
Kovalento obligāciju veidi
Atomi var veidot dažāda veida kovalentās saites: Vieninieki, dubultspēles vai trīsvietīgie.
Iekšā Vienkārša saite, divi atomi ir savienoti ar Elektronu pāris. Tie sastopami lielākajā daļā kovalento savienojumu, un tā ir šīs saites pamata forma.
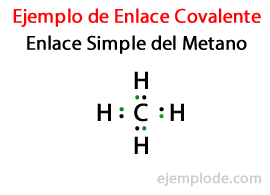
Daudzos savienojumos Double Links, tas ir, kad divi atomi dalās Divi elektronu pāri. Ja diviem atomiem ir divas elektronu pāri, kovalento saiti sauc par dubulto saiti. Šīs saites ir atrodamas tādās molekulās kā oglekļa dioksīds (CO2) un etilēna (C.2H4).

A Trīskārša saite rodas, kad divi atomi dalās Trīs elektronu pāri, tāpat kā slāpekļa N molekulā2, acetilēna C molekula2H2.

Vairākas saites ir īsākas nekā atsevišķas kovalentās saites. The Saites garums ir definēts kā attālums starp divu savienotu atomu kodolu ar kovalento saiti molekulā.
Atšķirības starp kovalentajiem un jonu savienojumiem
Joniskajiem un kovalentajiem savienojumiem ir izteiktas atšķirības to vispārējās fizikālajās īpašībās, jo to saitēm ir atšķirīgs raksturs.
Iekš Kovalenti savienojumi pastāvēt divu veidu pievilcīgie spēki; viens no tiem ir tas, kas satur kopā molekulas atomus. Šīs pievilcības kvantitatīvais rādītājs ir saistoša enerģija. Otrs pievilkšanas spēks darbojas starp pilnīgām molekulām un tiek saukts Starpmolekulārais spēks. Tā kā starpmolekulārie spēki parasti ir vājāki par spēkiem, kas satur molekulas atomus kopā, kovalento savienojumu molekulas saista ar mazāku spēku.
Drošībā, kovalenti savienojumi gandrīz vienmēr ir gāzes, šķidrumi vai cietas vielas ar zemu kušanas temperatūrun. No otras puses, elektrostatiskie spēki, kas satur jonus kopā jonu savienojumā tie parasti ir ļoti spēcīgi, lai jonu savienojumi istabas temperatūrā būtu cieti un ar augstu kušanas temperatūru. Daudzi jonu savienojumi šķīst ūdenī, un to ūdens šķīdumi vada elektrību, jo šie savienojumi ir spēcīgi elektrolīti.
Lielākā daļa no kovalenti savienojumi ūdenī nešķīstun, ja tie izšķīst, tā ūdens šķīdumi kā parasti tie nevada elektrību jo šie savienojumi ir neelektrolīti. Izkausētie jonu savienojumi vada elektrību, jo tie satur katjonus un anjonus, kas brīvi pārvietojas; šķidri vai izkausēti kovalenti savienojumi nevada elektrību, jo tajā nav jonu.
Kovalenti saistītu savienojumu piemēri
- Acetilēns C2H2
- Metāns CH4
- Etāns C2H6
- Propāns C3H8
- Butāns C4H10
- Benzols C6H6
- C toluols7H8
- Metilspirts CH3Ak
- Etilspirts C2H5Ak
- Propilspirts C3H7Ak
- Metilēteris CH3OCH3
- Metil-etilēteris C2H5OCH3
- Etilēteris C2H5OC2H5
- Skudrskābe HCOOH
- Etiķskābe CH3COOH
- Propionskābe C2H5COOH
- Sviestskābe C3H7COOH
- Oglekļa dioksīds CO2
- Oglekļa monoksīds CO
- Molekulārais slāpeklis N2
- Molekulārais ūdeņradis H2