Ķīmisko parādību piemērs
Ķīmija / / July 04, 2021
Ķīmija pēta vielas komponentus, to veidotos savienojumus un to iespējamās kombinācijas produkti, kas rodas no šīm kombinācijām, un to struktūra, un parādības, kas tos rada, paātrina vai kavē modifikācijas. A Ķīmiska parādība ir tāda, ka divām vai vairākām vielām notiek izmaiņas, kas maina to iekšējo struktūru, izraisot vienu, divas vai vairākas vielas, kas atšķiras no sākotnējās vielas.
Atšķirībā no fiziskām parādībām, kurās tiek mainītas dažas objektu īpašības, taču tās vienmēr ir viena un tā pati viela vai savienojums, fizikālajās parādībās mainās vielu struktūra, kā rezultātā paliek citas vielas, kas atšķiras no oriģināli. Tas nozīmē, ka visas ķīmiskās parādības ir ķīmiskas reakcijas, kuru rezultātā rodas viena vai vairākas vielas, kas molekulāri atšķiras no sākotnējās vielas vai vielām.
Ķīmisko parādību veidi:
Ķīmiskās parādības attiecībā uz rezultātu var klasificēt šādi:
Sintēze
Divi vai vairāki savienojumi savienojas kopā, veidojot sarežģītāku savienojumu.
Sadalīšanās
Komplekss savienojums sadalās, veidojot vienkāršākas molekulas.
Pārvietošana
Viens no reaģējošo molekulu elementiem vai radikāļi kļūst par daļu no otras molekulas, ar kuru tā reaģē.
Dubultā ritināšana
Reaģējošās molekulas apmainās ar elementu vai radikāļu, radot divas dažādas molekulas, uz kurām tās reaģēja.
Attiecībā uz reakcijām kā ķīmiskām parādībām mēs varam minēt sekojošo:
Oksidēšana
Oksidēšana ir reakcija, kurā skābeklis apvienojas ar citu elementu, iegūstot oksīdu metālu gadījumā un oksīdskābi, ja tas apvienojas ar nemetāliskiem elementiem. Reakcija ir lēna, un materiāla temperatūra nepalielinās.

Sadegšana
Sadegšana ir ātras oksidēšanās forma, kurā tiek izdalīta arī gaisma un siltums, tas ir, tā ir eksogēna reakcija.
Alkalizēšana
Tas ir tad, kad metāls apvienojas ar hidroksilgrupu (radikāls ar -OH formu).
Skābināšana
Tas ir tad, kad nemetālisko elementu apvieno ar ūdeņradi
Neitralizācija
Tā ir hidroksīda un skābes kombinācija, kā rezultātā veidojas ūdens un sāls.
Samazināšana
Tas ir skābekļa atdalīšana no oksīda, lai iegūtu tīru metālu, reaģējot ar ūdeņradi no skābes.
Jonizācija
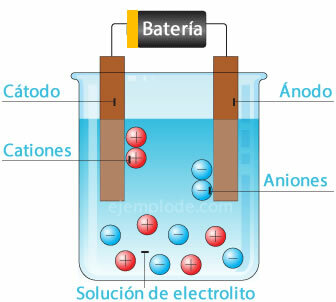
Izšķīdinot sāli ūdenī, elementi, kas to veido, tiek atdalīti atomos ar elektriskiem lādiņiem, kas var būt pozitīvi (katijons) vai negatīvi (anjons). Šāda veida šķīdumus sauc par elektrolītiem.
Elektrolīze
Kad elektriskā strāva tiek izvadīta caur elektrolītu, elektrība izraisa atomu atdalīšanos no ūdens. ūdeņraža jons ar pozitīvu lādiņu iet uz negatīvo polu (katodu) un skābeklis ar negatīvu lādiņu - uz polu pozitīvs (anods). Lietojot elektrolīzi skābē, viens no efektiem ir metāla elementa izspiešana līdz anodam.
Katalīze
Divas vielas, kas vispārējos apstākļos nereaģē vai ļoti lēni, var reaģēt ļoti ātri trešās vielas klātbūtnē, kas netiks mainīta ne pirms, ne tās laikā reakcija. Šāda veida vielu sauc par katalizatoriem.
Fermentācija
Tas ir ķīmisku izmaiņu iegūšana, jo īpaši organiskos savienojumos, baktēriju ietekmē.
Ķīmisko parādību piemērs:
1. Nekrāsotam grilam būs saskare ar gaisā un ūdenī esošo skābekli un sāks parādīties rūsas (oksidēšanās)
2. Koka tuvināšana ugunij izraisīs tās sadedzināšanu, izraisot dažas oglekļa molekulas, kas to veido ātri sajauc ar skābekli, atbrīvojot oglekļa dioksīdu, atstājot sadedzinātu koksni un kvēpus kā atlikumu (sadegšana)
3. Pārtikas sadalīšanās ir saistīta ar baktēriju gremošanas darbību, kas maina sastāvdaļu ķīmisko struktūru. (Fermentācija).
4. Automašīnas akumulators ražo elektrību, reaģējot starp elektrolītu un metāla šūnām, ar kurām tas veidojas, izraisot jonu izdalīšanos, kas ražo elektrību. Lai to uzlādētu, strāvas plūsma veic elektrolītisku darbību, kas jonus atgriež uz plāksnēm.
5. Automobiļa dzinēja radītās gāzes ir stabilas un gandrīz nesadalās pēc tam, kad tās atstājušas motoru un sasniegušas istabas temperatūru. Katalizatorā ir platīna putas, kuras, sildot līdz aptuveni 500 ° C, ļaujiet gāzēm sadalīties vienkāršākos savienojumos, bez platīna modifikācijas.
6. Izšķīdinot sāli ūdenī, tas sadalās nātrija un hlora jonos.
7. Gāzēts dzēriens, kas rodas, sajaucot citrona sulu ar soda, ir neitralizācijas reakcija.
8. Kad mēs asiņojam, asinis iegūst tumšāku krāsu, pateicoties dzelzs oksidācijai, kas atrodama sarkanajās asins šūnās. Tāpēc venozās asinis ir tumšākas un arteriālās asinis gaišākas.
9. Automašīnu detaļu hromēšana izmanto elektrolīzi, lai nogulsnētu hromu uz hromētās metāla daļas.
10. Sagremojot kā ķīmisku parādību, sālsskābes darbība uz pārtiku ir sašķelt kompleksas molekulas, kas tās veido, mazākās molekulās, kuras var vieglāk absorbēt zarnas.

