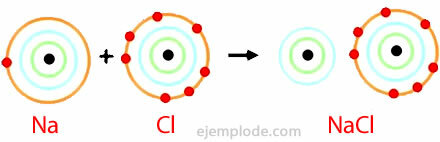
Jonu obligāciju piemērs
Ķīmija / / July 04, 2021
Jonu saiti nodrošina katjonu un anjonu klātbūtne - ķīmiskas sugas ar pretēju zīmju elektriskajiem lādiņiem. To definē kā elektrostatisko spēku, kas saista jonus jonu savienojumā.
Elementu ar zemu jonizācijas enerģiju atomiem ir tendence veidot katjonus. Turpretī tie, kuriem ir augsta elektronu afinitāte, parasti veido anjonus.
Sārmu un sārmzemju metāli biežāk veido katjonus jonu savienojumos, un halogēni un skābeklis visbiežāk veido anjonus. Rezultātā ļoti dažādu jonu savienojumu sastāvs rodas, apvienojot IA vai IIA grupas metālu un halogēnu vai skābekli.
Piemēram, reakcija starp litiju un fluoru rada litija fluorīdu, indīgu baltu pulveri, ko izmanto lodmetāla kušanas temperatūras pazemināšanai un keramikas ražošanā. Litija elektronu konfigurācija ir 1s2, 2s1un fluoram ir 1s2, 2s2, 2 P.5. Kad šie atomi nonāk saskarē, valences elektrons 21 Litijs tiek pārnests uz fluora atomu.
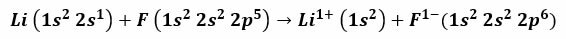
Ir pamatoti uzskatīt, ka procedūra sākas ar elektrona atdalīšanu no litija, to jonizējot, lai sasniegtu pozitīvo 1+ valenci. Tas turpinās ar fluora uzņemšanu šajā elektronā, kas tam piešķir negatīvu lādiņu. Galu galā jonu saites veidošanās notiek ar elektrostatisko pievilcību. Litija fluorīda savienojums būs elektriski neitrāls.
Daudzas izplatītas reakcijas noved pie jonu saišu veidošanās. Piemēram, kalcija sadegšana skābeklī rada kalcija oksīdu:
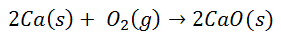
Diatomiskā skābekļa molekula atdalās divos atsevišķos atomos. Tad notiks divu elektronu pārnese no kalcija atoma uz katru skābekļa atomu. Pēc tam abiem būs savi lādiņi: kalcijam 2+ katram atomam un skābekļa 2- katram atomam. Pēc galīgās saites kalcija oksīda molekula ir elektriski neitrāla.
Jonu savienojumu režģu enerģija
Ar elementu jonizācijas enerģijas un elektronu afinitātes vērtībām ir iespējams paredzēt, kas elementi veido jonu savienojumus, bet ir arī jānovērtē šāda veida stabilitāte savienojumi.
Jonizācijas enerģija un elektronu afinitāte ir definēta procesiem, kas notiek gāzes fāzē, lai gan visi jonu savienojumi ir cieti pie 1 atmosfēras spiediena un 25 ° C. Cietais stāvoklis ir ļoti atšķirīgs stāvoklis, jo katru katjonu ieskauj noteikts skaits anjonu un otrādi. Līdz ar to cietā jonu savienojuma kopējā stabilitāte ir atkarīga no visu jonu mijiedarbības, nevis tikai no katjona mijiedarbības ar anjonu.
Kvantitatīvs jonu cietas vielas stabilitātes mērs ir tā režģa enerģija, kas ir definēts kā Enerģija, kas nepieciešama, lai gāzveida stāvoklī pilnībā atdalītu cieta jonu savienojuma molu tā jonos.
Born-Habera cikls, lai noteiktu režģa enerģiju
Tiešā režģa enerģiju nav iespējams izmērīt. Tomēr, ja ir zināma jonu savienojuma struktūra un sastāvs, tā režģa enerģiju ir iespējams aprēķināt, izmantojot Kulona likumu, kas norāda, ka potenciālā enerģija starp diviem joniem ir tieši proporcionāla to lādiņu reizinājumam un apgriezti proporcionāla attālumam starp tiem. Apstāties.
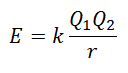
Tā kā katjona lādiņš ir pozitīvs, bet anjona - negatīvs, produkts enerģijā radīs negatīvu rezultātu. Tas ir eksotermiska reakcija. Līdz ar to, lai mainītu procesu, jāpiegādā enerģija.
Režģa enerģiju ir iespējams noteikt arī netieši, ja pieņem, ka jonu savienojums veidojas vairākos posmos. Šī procedūra ir pazīstama kā Born-Habera cikls, kas saista jonu savienojumu režģa enerģijas ar jonizācijas enerģijām, elektronisko afinitāti un citām atomu un molekulārajām īpašībām. Šī metode ir balstīta uz Hesa likumu par ķīmisko reakciju algebrisko summu, un to izstrādāja Makss Borns un Fricis Habers. Born-Habera cikls nosaka dažādus posmus, kas notiek pirms jonu cietvielas veidošanās.

Nātrija hlorīds
Nātrija hlorīds ir jonu savienojums ar kušanas temperatūru 801 ° C, kas elektrību vada izkausētā stāvoklī un ūdens šķīdumā. Akmens sāls ir viens no nātrija hlorīda avotiem, un tas atrodas pazemes nogulumos, kuru biezums parasti ir vairāki simti metru. Nātrija hlorīdu iegūst arī no jūras ūdens vai sālsūdens (koncentrēts NaCl šķīdums), iztvaicējot Sauli. Arī dabā tas atrodas minerālā, ko sauc par halītu.

Neorganisko ķīmisko savienojumu ražošanā nātrija hlorīdu izmanto vairāk nekā jebkuru citu materiālu. Šīs vielas patēriņš pasaulē ir aptuveni 150 miljoni tonnu gadā. Nātrija hlorīdu galvenokārt izmanto citu neorganisku ķīmisku savienojumu, piemēram, gāzveida hlora, nātrija hidroksīda, metāliskā nātrija, ūdeņraža gāzes un nātrija karbonāta ražošanā. To lieto arī ledus un sniega kausēšanai uz lielceļiem un ceļiem.