Kas ir elektrolīze
Ķīmija / / July 04, 2021
Ķīmijā Elektrolīze ir parādība, kurā elektriskā strāva iet caur jonu savienojuma ūdens šķīdumu, un sākas virzīt jonus (uzlādētas daļiņas) savienojuma a divi elektrodi, pozitīvs (Anods, piesaista negatīvi lādētus anjonus) un negatīvus (Katods, piesaista pozitīvi lādētos katjonus). Šo fenomenu regulē elektrostatikas likums, kas norāda, ka pretēji lādiņi piesaista viens otru.
Elektrolīti
1883. gadā Maikls Faradejs atklāja, ka noteiktu vielu ūdens šķīdumi vada elektrisko strāvu, bet citu vielu šķīdumi to nedara.
Lai pārbaudītu, vai ūdens šķīdums vada elektrisko strāvu, Faradejs izstrādāja vienkāršu aparātu, kas sastāv no a 110 voltu līdzstrāvas ķēde, lampa, Y divi savienoti metāla vai grafīta elektrodi uz pašreizējo avotu.
Ja elektrodi ir iegremdēti ūdenī, plūstošās strāvas daudzums ir tik mazs, ka lampa nedeg; tas pats sakāms, ja tos iemērc cukura šķīdumā.
Gluži pretēji, ja tie ir iegremdēti šķīdumā Nātrija hlorīds NaCl vai no Sālsskābe HCl, lampa spīd spoži, kas pierāda, ka izšķīdināšana ir lielisks diriģents
. No otras puses, izmantojot etiķskābi CH3Koncentrēts COOH, šķīdums slikti vada strāvu, bet, kad skābi atšķaida ar ūdeni H2Vai arī tā elektrovadītspēja palielinās.Strāvas pārejas laikā caur dažādiem risinājumiem pie elektrodiem tiek iegūti dažādi produkti.
Elektrolīzes pētījumu laikā Faradejs secināja šādus likumus:
1. likums: Vielas daudzums, kam ir ķīmiskā pārveidošanās elektrodā, ir proporcionāls elektrības daudzumam, kas iet caur šķīdumu.
2. likums: Ja caur dažādiem risinājumiem tiek izvadīts vienāds elektroenerģijas daudzums, vielu svars sadalīti vai nogulsnējušies uz dažādiem elektrodiem, ir proporcionāli minēto ekvivalentajiem svariem vielas.
Lai minētu piemēru:
Tiks pieņemts, ka jums ir piecas dažādas elektrolītiskās šūnas. Pirmais ar Sālsskābes HCl, otrais ar Vara sulfāts CuSO4, trešais ar Antimonious Chloride SbCl3, ceturtais ar Alvas hlorīds SnCl2 un piektais ar Stannic Chloride SnCl4.
Tā pati strāva tiek izvadīta caur elektrolītisko šūnu sēriju līdz 1008 gramiem ūdeņraža (a Sālsskābes šķīduma ekvivalents ūdeņraža svars), vienlaikus izlaisto citu produktu svars (gramos) Viņi ir:
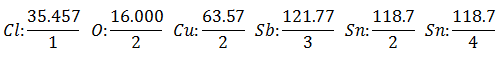
The Ekvivalents svars ir vērtība Elementa atomsvars dalīts ar elementa Valensiju.
Lai atbrīvotu jebkura priekšmeta ekvivalentu svaru, jums ir nepieciešams 96500 Kulonas. Šis elektrības daudzums tiek saukts 1 Faradeja.
Faradejas vienība
Ampērs tiek definēts kā vienota plūsma, kas no sudraba nitrāta (AgNO) šķīduma nogulsnē 0,001118 gramus sudraba (Ag).3) sekundē. Tā kā sudraba atomu masa ir 107,88 g / mol, attiecība 107,88 / 0,001118 dod ampēri sekundes vai Kulombs nepieciešama elektrība deponēt sudraba ķīmisko ekvivalentu. Šis lielums ir 96494 kuloni (96500 vērtība ir diezgan aptuvena vienkāršākiem aprēķiniem), un to sauc par 1 Faraday of Electricity.
Elektrodi
Faradejs piezvanīja Anods pret pozitīvo elektrodu un katods uz negatīvo elektrodu. Viņš arī izveidoja terminus Anions un Katijons, kas lietoti vielām, kas attiecīgi parādās pie anoda un katoda elektrolīzes laikā.
Pašlaik cita elektrodu definīcija ir:
Anods: Elektrods, kurā ir elektronu zudums vai oksidēšanās.
Katods: Elektrods, kurā notiek elektronu pieaugums vai reducēšana.
Elektrolīti un neelektrolīti
Elektriskās strāvas vadīšana, izmantojot risinājumus, tika apmierinoši izskaidrota tikai 1887. gadā, kad Svante Arrhenius darīja zināmu savu teoriju. Pirms novērtēt un izprast Arrhenius teoriju, mēs vispirms izklāstījām dažus faktus, kas zinātnei bija zināmi, kad Arrhenius to formulēja:
The Neelektrolītu šķīdumi viņiem ir īpašības, kuras var aprēķināt, piemērojot Raula likumu. Šo šķīdumu tvaika spiediens un novērotie vārīšanās un sasalšanas punkti praktiski neatšķiras no aprēķinātajām vērtībām.
The Raula likums paskaidro, ka katra šķīdumā esošās izšķīdušās vielas tvaika spiediens ir atkarīgs no tā paša mola frakcijas tajā, reizināts ar tvaika spiedienu tīrā stāvoklī.

Raula likums neizdodas, ja to piemēro elektrolītu šķīdumiem ūdenī. Tvaika spiediena un vārīšanās un sasalšanas punktu svārstības vienmēr ir lielākas nekā paredzētas iepriekšminētajā likumā, un turklāt tās palielinās atšķaidot.
Šādas novirzes attēlo vērtība i, kas ir sasalšanas temperatūrā novēroto izmaiņu attiecība starp sasalšanas punktā aprēķinātajām izmaiņām:

I vērtība ir novirzes no Raula likuma mērvienība, kas ir vienāda ar 1, ja nav novirzes.
Elektrolītu elektrovadītspēja
Arrhenius pētīja elektrolītu ūdens šķīdumu vadītspēju, lai uzzinātu, kā vadītspēja mainījās ar elektrolīta koncentrāciju.
Tas izmēra molāro vadītspēju (kas ir vadītspēja, kas atbilst vienam molam izšķīdušā elektrolīta; tas ir, īpatnējā vadītspēja attiecās uz vienu molu un konstatēja, ka tā palielinājās ar atšķaidīšanu.
Arrhenius salīdzināja savus rezultātus ar noviržu mērījumiem no Raula likuma un atrada ciešu saistību starp šiem un molāro vadītspēju. Viņa teorijā elektrolītu uzvedība ir izskaidrota:
“Elektrolītu molekulas sadalās elektriski uzlādētās daļiņās, ko sauc par joniem. Izšķīšana nav pilnīga, un starp molekulām un to joniem ir līdzsvars. Joni, virzoties šķīdumā, vada strāvu ”.
Atkāpes no Raula likuma ir saistītas ar daļiņu skaita pieaugumu, kas rodas daļējas molekulu disociācijas rezultātā.
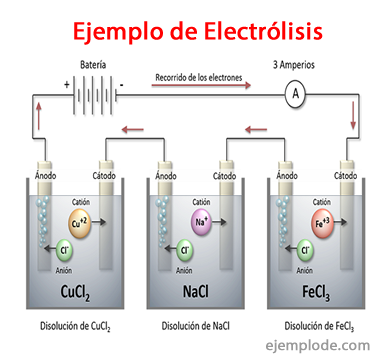
Elektrolīzes piemēri
Daži risinājumi, kas darbojas tāpat kā elektrolīti, tas ir, tie spēj veikt elektrolīzi, ir:
Nātrija hlorīds NaCl
Sālsskābes HCl
Nātrija sulfāts Na2DR4
Sērskābe H2DR4
Nātrija hidroksīds NaOH
Amonija hidroksīds NH4Ak
Nātrija karbonāts Na2CO3
Nātrija bikarbonāts NaHCO3
Slāpekļskābe HNO3
Sudraba nitrāts AgNO3
Cinka sulfāts ZnSO4
