Organisko savienojumu nomenklatūras piemērs
Ķīmija / / July 04, 2021
Organiskie savienojumi ir molekulas, kuru raksturīga iezīme ir tā, ka tos veido oglekļa molekulu bāze un ūdeņradis, pazīstams arī kā skelets, un apvienojumā ar citiem elementiem, galvenokārt ar skābekli, slāpekli un sēru.
The IUPAC (Starptautiskā tīrās un lietišķās ķīmijas savienība, Starptautiskā tīras un lietišķās ķīmijas savienība) ir izveidoti vispārīgi noteikumi par organisko molekulu klasifikāciju un nomenklatūru, no kuriem mēs izskaidrojam vissvarīgāko.
Ogļūdeņraži
Ogļūdeņraži ir vienkāršākās organiskās molekulas, ko veido oglekļa skelets un ūdeņraža atomi. Ir trīs veidu ogļūdeņraži:
Alkāni
Tie ir vienkāršākie, ko veido oglekļa atomi, kas savienoti ar vienkāršām kovalentām saitēm ar ūdeņradis ar vispārēju formulējumu H = 2n + 2, tas ir, ūdeņraža atomi ir divreiz vairāk nekā ūdeņraža atomi. ogleklis, plus 2. Tās nomenklatūru veido ciparu prefiksi met-1 oglekļa atomam, et- 2, prop- 3 un but- 4; no 5 oglekļa atomiem tiek izmantoti kopējie priedēkļi pent-, hex-, hept-, oct- utt. Visiem alkāniem pievieno galotni -ano.
Piemērs: CH4: metāns; C2H6: etāns; C4H10: butāns; C6H14: heksāns
Alkēnus
Tos veido oglekļa skelets, kurā starp oglekļa atomiem ir divkārša saite. Tās vispārējā formula ir H = 2n, tas ir, tā ūdeņraža atomi ir divreiz lielāki par oglekļa atomiem. Tāpat kā alkāni, viņi izmanto prefiksus, kas norāda to oglekļa atomu skaitu, un šajā gadījumā tiek pievienots galotne -eno. Turklāt molekulās ar vairāk nekā trim oglekļa atomiem ogleklis, kur atrodama dubultā saite, sākot skaitīt no oglekļa, kas ir vistuvāk ir.
Piemēri: C2H4: etēns; C3H6: propēns; C4H8: butēns, 2-butēns; C6H12: Heksēns, 2-heksēns (divkāršā saite pie 2. atoma), 3-heksēns (dubultā saite pie 3. atoma).
Alkīni
Alkīni pie to oglekļa atomiem satur trīskāršu saiti. Tās vispārējā formula ir H = 2n-2, kas norāda, ka molekula satur divus ūdeņraža atomus, kas ir mazāk nekā divreiz vairāk nekā oglekļa atomi. Prefiksam, kas norāda ogļu skaitu, pievieno galotni -ino. Tāpat kā alkēnu gadījumā, tiek pieminēts ogleklis, kas satur trīskāršo saiti, skaitot no galējā, kas tam ir vistuvāk.
Piemēri: C2H2: etīns; C3H4: padoms; C4H6: butīns, 2-butīns; C6H12: Heksino, 2-heksēns (trīskāršā saite pie 2. atoma), 3-heksīns (trīskāršā saite pie 3. atoma).
Funkcionālās grupas
Funkcionālās grupas ir atomu kombinācijas, kas darbojas kā joni un alkāna formulā aizstāj ūdeņraža atomu.
Radikāļi
Alkānu bez ūdeņraža atoma sauc par radikālu, un tā identificēšanai tiek pievienots galotne -ilo:
Piemēri CH4: metāns - CH3+ metilgrupa; C2H6: etāns - C.2H5+ etils; C4H10: butāns - C.4H9+ butils; C6H14: heksāns - C.6H13+ heksils.
Ogļūdeņražu savienojums
Viens no gadījumiem, kas var notikt, ir tas, ka molekulā ir apvienoti divi vai vairāki ogļūdeņraži. Ogļūdeņražus, ar kuriem tas tiek apvienots, sauc par arborescencēm. Šajos gadījumos bāzes ogļūdeņradis būs tas, kuram ir garākā ķēde, un ogļu skaits, kur tiek atrastas arborescences, kam seko radikāļa nosaukums ar galotni -il un pēc tam ogļūdeņraža nosaukums bāze. Numurs tiks minēts tik reižu, cik tam piestiprinātas koku līnijas. Gadījumā, ja arborescences ir viena radikāļa dažādos oglekļa atomos, tiks minēti ar komatiem atdalītie skaitļi, kam seko defise radikāļa nosaukums, pēc tam to atomu skaits, pie kuriem piestiprināts otrs radikāls, ja tāds ir, domuzīme, radikāļa nosaukums un ogļūdeņraža nosaukums bāze. Gadījumā, ja vienam un tam pašam oglekļa atomam ir pievienoti divi radikāļi, skaitlis tiks minēts divreiz. Ja tie ir dažādi radikāļi, tad tas tiks minēts vienu reizi pirms katra radikāļa nosaukuma; ja radikāļi ir vienādi, skaitlis tiks minēts divreiz. Vispirms mēs vispirms pieminēsim vienkāršākās arborescences (tās, kurās ir vismazāk ogļūdeņražu), un pēc tam tās, kurām ir vislielākais daudzums.
Piemērs: pentāna molekula ar diviem etāna radikāļiem, kas piesaistīti pie 2. un 3. oglekļa:
2,3-etil-pentāns. Oktāna molekula, propāna radikāls pie oglekļa 6, metāna radikāļi pie 4. un 5. ogles un etāna radikāļi, kas saistīti ar 2., 3. un 4. ogli: 4,5-metil-2,3,4-etil-6-propilgrupa -oktāns.
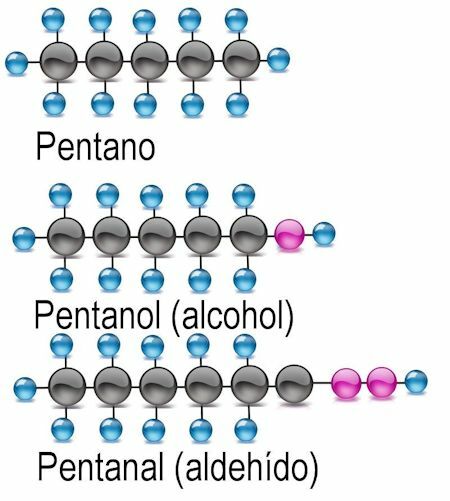
Alkohola funkcionālā grupa
Vienkāršākā no funkcionālajām grupām ir alkohols, kurā ūdeņraža atoms tiek aizstāts ar hidroksilgrupu (OH). Šajos savienojumos radikāla nosaukumam tiek pievienots -anols. Vajadzības gadījumā jāpiemin oglekļa atoms, kurā atrodas funkcionālā grupa:
Piemēri CH3OH: metanols: C2H5OH etanols; C4H9OH butanols vai 2-butanols; C6H13OH heksanols, 2-heksanols (2. atoma funkcionālā grupa), 3-heksanols (3. atoma funkcionālā grupa).
Aldehīda funkcionālā grupa
Aldehīdos ūdeņraža atoms tiek apmainīts pret funkcionālo grupu -CHO. Lai tos identificētu, pievieno galu -anal un tiek pieminēts arī oglekļa atoms, kurā atrodas funkcionālā grupa:
Piemēri CH3COH: metanāls: C.2H5Etanālā COH; C4H9COH butanāls vai 2-butanāls; C6H13COH heksanāls, 2-heksanāls (2. atoma funkcionālā grupa), 3-heksanāls (3. atoma funkcionālā grupa).
Skābes funkcionālā grupa
Organiskajās skābēs ūdeņraža atoms tiek apmainīts pret funkcionālo grupu -COOH. Lai tos identificētu, tiek pieminēts vārds skābe un pievienots gala -anoisks, kā arī pieminēts oglekļa atoms, kurā atrodas funkcionālā grupa:
Piemēri CH3COOH: metānskābe: C2H5COOH etānskābe; C4H9COOH butānskābe vai 2-butānskābe; C6H13COH heksānskābe, 2-heksānskābe (2. atoma funkcionālā grupa), 3-heksānskābe (3. atoma funkcionālā grupa).


