20 voorbeelden van chemische verschijnselen
Diversen / / July 04, 2021
De chemische verschijnselen (of chemische reacties) zijn die verschijnselen waarin veranderingen in de materie optreden, en nieuwe stoffen genaamd "producten" worden gevormd, en andere genaamd "reactanten" ontleden. Bijvoorbeeld: houtrot, papierverbranding, composteren.
Chemische reacties kunnen zijn: spontaan (reacties die plaatsvinden zonder dat er energie of katalysatoren nodig zijn) of niet spontaan (reacties waarvoor de bijdrage van energie, katalysatoren of een externe interventie nodig is). Om een reactie te laten plaatsvinden is het vaak nodig dat de reagentia een temperatuur- specifiek, een pH een ingestelde drukwaarde, enz.
Het kan ook essentieel zijn om de snelheid waarop chemische reacties plaatsvinden. De katalysatoren Het zijn stoffen die aan een chemische reactie worden toegevoegd om de snelheid te verhogen, terwijl remmers stoffen zijn die de snelheid van chemische reacties vertragen. Andere factoren die de snelheid van een chemische reactie beïnvloeden, zijn temperatuur, druk, de concentratie van reactanten en de aard van de reactie zelf.
Het kan u van dienst zijn:
Soorten chemische verschijnselen
Chemische reacties kunnen zijn:
Anorganische reacties. Ingrijpen anorganische verbindingen en kan worden ingedeeld volgens:
- De zin waarin de reactie plaatsvindt.
-
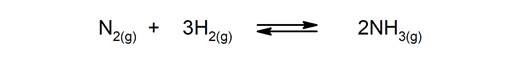
Omkeerbare reacties. Ze komen in beide richtingen voor, dus de producten kunnen afbreken en opnieuw de reactanten vormen.
-
Onomkeerbare reacties. Ze gebeuren maar op één manier.

-
Omkeerbare reacties. Ze komen in beide richtingen voor, dus de producten kunnen afbreken en opnieuw de reactanten vormen.
- Het type deeltje dat reageert.
-
Zuur-base reacties. H ionenoverdracht vindt plaats+.

-
Oxidatie-reductiereacties. Een van de reactanten oxideert (verhoogt het aantal oxidatie), terwijl de andere wordt verminderd (het oxidatiegetal neemt af). Bij deze reacties vindt elektronenoverdracht plaats.

-
Zuur-base reacties. H ionenoverdracht vindt plaats+.
- De reactiesnelheid.
-
Snelle reacties. Ze ontstaan in een zeer korte tijd.
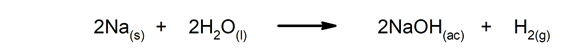
-
Trage reacties Het duurt lang voordat ze klaar zijn.
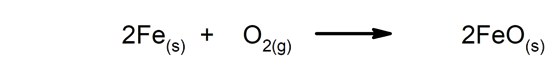
-
Snelle reacties. Ze ontstaan in een zeer korte tijd.
- De vorm van de energie die het uitzendt of absorbeert.
-
Exotherme reacties. Als ze zich voordoen, geven ze warmte af.
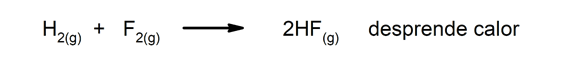
-
Endotherme reacties. Wanneer ze zich voordoen, nemen ze warmte op.

-
Exolumineuze reacties. Wanneer ze zich voordoen, zenden ze licht uit.

-
Endolumineuze reacties. Om te gebeuren, hebben ze licht nodig.

-
Exotherme reacties. Als ze zich voordoen, geven ze warmte af.
- Het type transformatie.
-
Synthese- of additiereacties. Twee stoffen vormen samen een nieuwe stof.
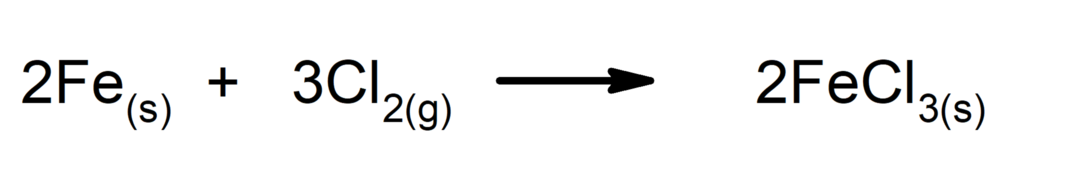
-
Ontledingsreacties. Een of meer stoffen vallen uiteen in hun eenvoudigste bestanddelen.
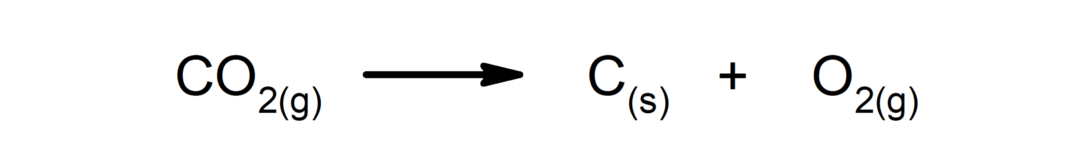
-
Verplaatsings- of substitutiereacties. Het ene element of de verbinding vervangt het andere in een verbinding en geeft het vrij.
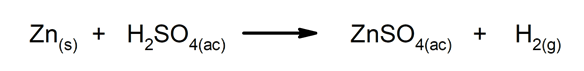
-
Dubbele substitutiereacties. Twee verbindingen wisselen tegelijkertijd elementen of verbindingen uit.

-
Synthese- of additiereacties. Twee stoffen vormen samen een nieuwe stof.
Organische reacties. Het zijn reacties waarbij organische verbindingen tussenkomen. Ze hebben veel classificaties op basis van het type organische verbinding dat reageert en het type reactie dat het ondergaat. Enkele voorbeelden zijn:
-
Halogenering van alkanen. Een waterstof wordt vervangen door a alkaan door een halogeen.
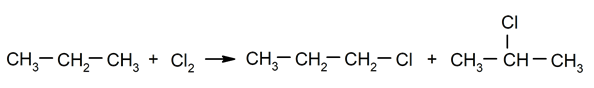
-
Verbranding van alkanen. Een alkaan reageert met zuurstof om koolstofdioxide en water te genereren, als de verbranding volledig is.
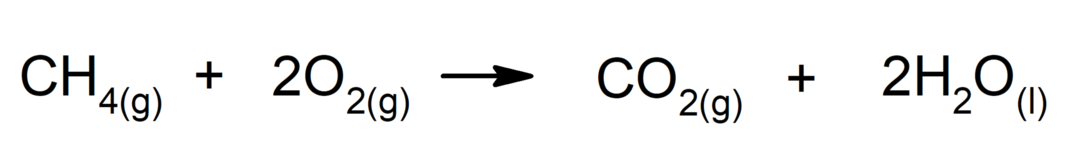
-
Halogenering van alkenen. Halogenen zijn gesubstitueerd voor een of beide waterstofatomen van de koolstoffen die betrokken zijn bij de dubbele binding.
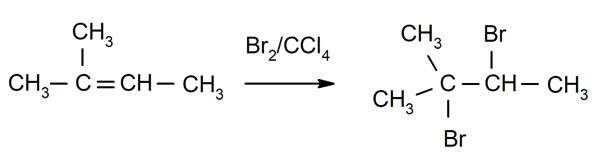
-
Hydrogenering van alkenen. Waterstoffen worden toegevoegd aan de koolstoffen die betrokken zijn bij de dubbele binding om het overeenkomstige alkaan te vormen.
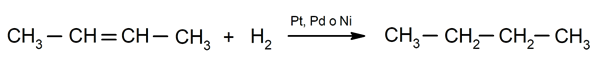
Belang van chemische verschijnselen
Veel chemische verschijnselen leven in stand houden van levende wezens, zoals de spijsvertering bij mensen en dieren, fotosynthese in planten en ademhaling in beide.
Een ander zeer belangrijk chemisch proces, vooral in het leven van micro-organismen, is de fermentatie, die gewoonlijk wordt gebruikt bij de vervaardiging van voedsel zoals kazen, yoghurt, wijn en bier.
Al de toename en de groei van een levend wezen Het gaat om chemische reacties die erin plaatsvinden, soms gestimuleerd door bepaalde omgevingsomstandigheden.
Voorbeelden van chemische verschijnselen
Om ons heen zijn er talloze gevallen van chemische verschijnselen of processen die deze omvatten:
- houtrot
- Verbranding van papier
- Weerstand tegen antibiotica bacteriën
- Melk die zuur wordt
- Een wond desinfecteren met alcohol
- Fruitzout gebruiken om brandend maagzuur te bestrijden
- Een kaars branden
- Bloedstolling
- Spiervermoeidheid na intensieve training
- Dood van insecten door insecticiden
- Roquefort kaas verkrijgen
- Het verkrijgen van cider
- Yoghurt verkrijgen
- Composteren
- Inkuilen
- Bio-ethanol halen uit melasse
- Gezwollen blikjes
- rot ei
- Roesten van een rooster
- Biodiesel halen uit palmolie
Chemische verschijnselen in de industrie
Bepaalde chemische fenomenen zijn ook de sleutel in deindustrie. Om te beginnen, de verbranding van koolwaterstoffen (zoals benzine, diesel of kerosine) produceert: Energie om de machines te laten draaien die talloze industriële processen afhandelen.
Aan de andere kant, de staalindustrie, papier, plastic, bouwmaterialen, verf, medicijnen, producten voor de agro, enz., zijn gebaseerd op verschillende chemische fenomenen zoals galvanisatie, elektrolyse en vele anderen meer.
De generatie van nieuwe energiebronnen (zoals biodiesel en bio-ethanol) is ook gebaseerd op dit soort fenomeen.
De transformatie van energie
Bij chemische verschijnselen is het gebruikelijk dat er energie transformatie. Wanneer bijvoorbeeld de chemische energie in de bindingen van een bepaald molecuul wordt omgezet in elektrische energie of vrijkomt als warmte (dit komt voor bij exotherme verschijnselen, zoals wanneer zoutzuur wordt gemengd met zink), is er een transformatie van Energie. Hetzelfde gebeurt wanneer lichtenergie wordt opgevangen en omgezet in chemische energie.
Sommige chemische processen hebben warmte nodig om te kunnen werken en worden 'endotherm' genoemd. Anderen vereisen de aanwezigheid van katalysatoren of cofactoren.
