20 voorbeelden van zure zouten
Diversen / / July 04, 2021
In de anorganische scheikunde zouten worden verbindingen genoemd die worden verkregen wanneer a zuur de waterstofatomen worden vervangen door metallische kationen (hoewel soms door niet-metalen kationen, bijvoorbeeld het ammoniumkation, NH4+). In het specifieke geval van zure zoutenzijn de waterstofatomen van het zuur gedeeltelijk gesubstitueerd, dat wil zeggen, er blijft ten minste één ongesubstitueerde waterstof over als onderdeel van het zout. Daarin onderscheiden ze zich van neutrale zouten, waar de waterstofatomen van het zuur volledig zijn gesubstitueerd.
De jij gaat uit worden meestal gevormd door de reactie tussen a zuur en een hydroxide (baseren). Bij deze reacties verliest de base normaal gesproken zijn hydroxylgroepen (-OH) en het zuur verliest ze. atomen waterstof (H), waarbij een neutraal zout wordt gevormd; maar als het betreffende zuur ten minste één van zijn waterstofatomen behoudt, waardoor de elektrische lading van de reactie verandert, zullen we een zuur zout of een gehydrogeneerd zout verkrijgen.
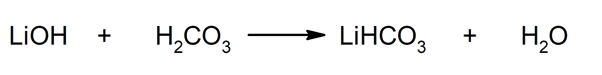
Zo worden bijvoorbeeld lithiumbicarbonaat en water verkregen uit de reactie tussen lithiumhydroxide en koolzuur:
Nomenclatuur van zure zouten
Zure zouten kunnen worden genoemd volgens: drie soorten meest voorkomende naamgeving:
Voorbeelden van zure zouten
- Natriumbicarbonaat (NaHCO3). Ook wel natriumwaterstofcarbonaat (IV) genoemd, het is een witte kristallijne vaste stof, oplosbaar in water, die in de natuur kan worden gevonden in de staat mineraal of het kan in het laboratorium worden geproduceerd. Het is een van de bekendste zure zouten en wordt veel gebruikt in zoetwaren, farmacologie of het maken van yoghurt.
- Lithiumbicarbonaat (LiHCO3). Dit zure zout is gebruikt als vangmiddel voor CO2 in situaties waar dergelijk gas ongewenst is, zoals bij de Noord-Amerikaanse "Apollo"-ruimtemissies.
- Kaliumdihydrogenfosfaat (KH2PO4). Het is een kristallijne vaste stof, geurloos, oplosbaar in water, veel gebruikt in verschillende industrieën zoals gist van voedsel, chelaatvormer, voedingsversterker en assistent bij de fermentatieprocessen.
- Natriumbisulfaat (NaHSO4). Het is een zuur zout gevormd door de neutralisatie van zwavelzuur. Het wordt veel industrieel gebruikt bij de raffinage van metalen en schoonmaakproducten. Hoewel het zeer giftig is voor sommige stekelhuidigen, wordt het gebruikt als additief in voedsel voor huisdieren en bij de vervaardiging van sieraden.
- Natriumwaterstofsulfide (NaHS). Het is een gevaarlijke verbinding om te hanteren, omdat het zeer corrosief en giftig is. Het kan ernstige brandwonden en oogletsel veroorzaken, omdat het ook brandbaar is.
- Calciumwaterstoffosfaat (CaHPO4). Het wordt gebruikt als voedingssupplement in granen voor vee. Het is een vaste stof die onoplosbaar is in water, maar kan kristalliseren wanneer het wordt gehydrateerd door twee te consumeren moleculen van water.
- Ammoniumwaterstofcarbonaat ([NH4] HCO3). Ook bekend als "ammoniumbicarbonaat", wordt het in de voedingsindustrie gebruikt als gist chemisch, hoewel het als nadeel heeft dat het ammoniak opsluit en voedsel een slechte smaak geeft als het wordt gebruikt in overmaat. Het wordt ook gebruikt in brandblussers, het maken van pigmenten en om rubber uit te zetten.
- Bari bicarbonaatof (Ba [HCO3]2). Het is een zuur zout dat bij verhitting de productiereactie kan omkeren en zeer onstabiel is, behalve in oplossing. Het wordt veel gebruikt in de keramische industrie.
- Natriumbisulfiet (NaHSO3). Dit zout is extreem onstabiel en wordt in aanwezigheid van zuurstof omgezet in natriumsulfaat (Na2SW4), daarom wordt het in de voedingsindustrie gebruikt als conserveermiddel en droogmiddel voor levensmiddelen. Het is een extreem reductiemiddel en wordt veel gebruikt door de mens, ook gebruikt bij het fixeren van kleuren.
- Calciumcitraat (AC3[C6H5OF7]2). Algemeen bekend als bitterzout, wordt het gebruikt als conserveermiddel voor levensmiddelen en als voedingssupplement wanneer het is gekoppeld aan het aminozuur lysine. Het is een wit, geurloos, kristallijn poeder.
- Monocalciumfosfaat (Ca [H2PO4]2). Het is een kleurloze vaste stof die wordt verkregen door de reactie van calciumhydroxide en fosforzuur, die veel wordt gebruikt als rijsmiddel of als meststof in landbouwwerkzaamheden.
- Dicalciumfosfaat (CaHPO4). Ook bekend als calciummonowaterstoffosfaat, heeft het drie verschillende kristallijne vormen die worden gebruikt als additief in voedsel en aanwezig is in tandpasta's. Bovendien wordt het van nature gevormd in nierstenen en in de zogenaamde "niersteen".
- Monomagnesiumfosfaat (MgH4P2OF8). Het is een wit, kristallijn en geurloos zout, gedeeltelijk oplosbaar in water. Het wordt gebruikt bij het conserveren van voedsel, als zuurteregelaar, als zuurteregelaar of middel bij de behandeling van: meel.
- Natriumdiacetaat (NaH [C2H3OF2]2). Dit zout wordt gebruikt als smaakstof en conserveermiddel in maaltijden, waardoor het verschijnen van paddestoelen en mycobacteriën, zowel in vacuümverpakte producten zoals vleeswaren als in de meelindustrie.
- Calciumbicarbonaat (Ca [HCO3]2). Het is een gehydrogeneerd zout dat afkomstig is van calciumcarbonaat, aanwezig in mineralen zoals kalksteen, marmer en andere. Deze reactie omvat de aanwezigheid van water en CO2, dus het kan spontaan voorkomen in grotten en grotten die rijk zijn aan calcium.
- Rubidiumzuurfluoride (RbHF). Dit zout wordt verkregen door de reactie van fluorwaterstofzuur (waterstof en fluor) en rubidium, een alkalimetaal. Het resultaat is een giftige en bijtende stof waarmee voorzichtig moet worden omgegaan.
- Monoammoniumfosfaat ([NH4] H2PO4). Het is een in water oplosbaar zout dat wordt geproduceerd door de reactie van ammoniak en fosforzuur. Het wordt meestal gebruikt als meststof, omdat het de grond de voedingsstoffen van stikstof en fosfor die nodig zijn voor plantengroei. Het maakt ook deel uit van het ABC-poeder in brandblussers.
- Zinkwaterstoforthoboraat (Zn [HBO3]). Het is een zout dat wordt gebruikt als antisepticum en als additief bij de vervaardiging van keramiek.
- Mononatriumfosfaat (NaH2PO4). Het wordt meestal in laboratoria gebruikt als een "buffer" of bufferoplossing, die plotselinge veranderingen in de pH van een oplossing voorkomt.
- Kaliumwaterstofftalaat (KHP). Ook wel "kaliumzuurftalaat" genoemd, het is een vast en stabiel zout in gewone lucht, daarom wordt het vaak gebruikt als primaire standaard bij metingen van pH. Het is ook nuttig als buffermiddel in chemische reacties.
Volgen met:


