15 Voorbeelden van diffusie en osmose
Diversen / / July 04, 2021
De diffusie en osmose het zijn processen van passief transport (ze hebben geen extra energie nodig om te voorkomen, in tegenstelling tot actief transport) van deeltjes van één of meer stoffen gevonden in verschillende concentraties van opgeloste stof en ze worden met elkaar in contact gebracht, hetzij via een semi-permeabel membraan (in het bijzonder geval van osmose) of op een andere manier.
Wat is uitzenden?
Diffusie is een fysiek proces die is gebaseerd op de stroom van deeltjes van een stof uit een gebied met een hoge concentratie van opgeloste stof naar een lage concentratie toe, totdat de concentratie in beide ongeveer gelijk is zones. De beweging van de deeltjes is gebaseerd op hun Kinetische energieMet andere woorden, er is geen externe energie-invoer voor diffusie. Bijvoorbeeld: de doorgang van zuurstof in de longblaasjes.
Deze beweging vindt plaats in een van de aggregatie staten van de er toe doen, maar het is gemakkelijker waar te nemen in het geval van vloeistoffen en gassen. De tendens van de beweging is in de richting van de vorming van a
mengen uniform van de twee soorten deeltjes.De wetenschapper Adolf Fick stelde in 1855 enkele wetten vast die zijn naam dragen, en beschrijven verschillende gevallen van de verspreiding van materie in een medium waarin aanvankelijk geen evenwicht is. Deze wetten hebben betrekking op de dichtheid van de stroom van de deeltjes met het verschil in concentratie tussen de twee afzonderlijke media, zijn coëfficiënt diffusie en permeabiliteit van het membraan (indien het scheidingsmedium een membraan is) semipermeabel).
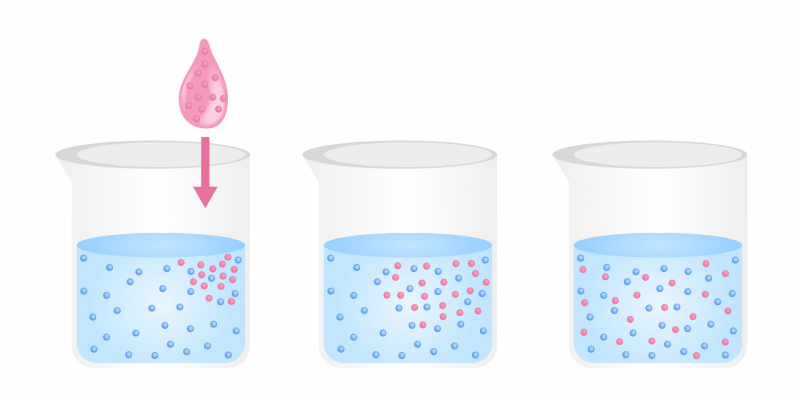
Voorbeelden van diffusie
- De doorgang van zuurstof in de longblaasjes.
- Zenuwimpulsen, die betrekking hebben op: ionen natrium en kalium over het membraan van de axonen.
- Als u een diffuserpaar neemt bestaande uit twee metalen via hun gezicht met elkaar in contact worden gebracht, worden ze verwarmd tot boven het punt van fusie en vervolgens afkoelen, zal worden geverifieerd dat de samenstelling is veranderd: diffusie van nikkelatomen naar koper en vice versa vond plaats.
- Het opwarmen en van kleur veranderen van een kopje koffie wanneer een goede hoeveelheid koude melk wordt toegevoegd.
- Het binnendringen van glucose in de rode bloedcellen, afkomstig uit de darm.
- In een estuarium is er een minder dichte diffusie van rivierwater dat over het water van zee.
- Als je een eetlepel suiker in een glas water doet, moleculen van sucrose diffuus door het water.
- Verspreiding van gassen is te zien wanneer een geparfumeerd persoon een afgesloten ruimte betreedt, en iedereen voelt de geur onmiddellijk. Hetzelfde gebeurt als iemand binnenshuis rookt.
Wat is osmose?
Osmose is een vorm van diffusie, maar met twee bijzondere kenmerken:
Op deze manier wordt waargenomen dat het oplosmiddel de neiging heeft om door het membraan te gaan in de richting van de ontbinding waarvan de concentratie hoger is, wat resulteert in een toename van de hoeveelheid oplosmiddel in het meest geconcentreerde deel (in opgeloste stof) en een afname in de minder geconcentreerd deel (in opgeloste stof), dat wil zeggen, het oplosmiddel verplaatst zich van het gebied met de laagste concentratie in opgeloste stof naar het gebied met de hoogste concentratie in opgeloste stof. Dit is een proces dat wordt herhaald totdat de concentratie (zowel opgeloste stof als oplosmiddel) van de oplossing aan beide zijden van het membraan gelijk is.
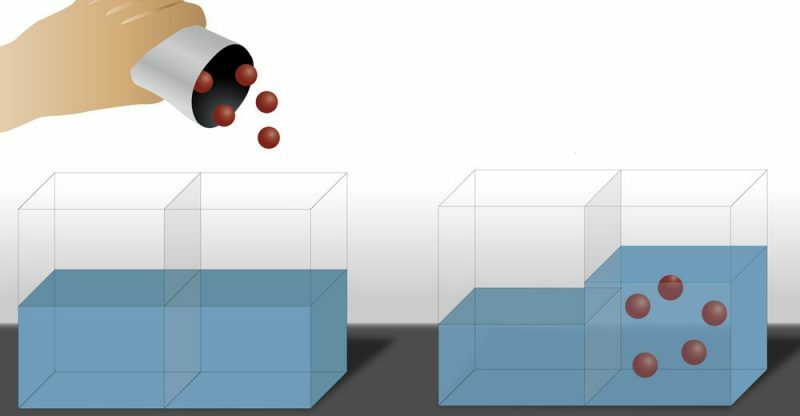
Er is ook de Inverse osmose, waarbij de passage van het oplosmiddel in de tegenovergestelde richting plaatsvindt dan conventionele osmose, dat wil zeggen, het oplosmiddel beweegt van de oplossing die meer geconcentreerd is in de opgeloste stof naar de minder geconcentreerde oplossing. Om dit te bereiken, wordt druk uitgeoefend op de oplossing die meer geconcentreerd is in opgeloste stof.
Omdat het belangrijk is?
De oplosbaarheid van de opgeloste stof in het oplosmiddel en de aard van het te gebruiken semi-permeabele membraan zijn de fundamentele factoren die de effectiviteit bepalen van het osmotische proces: een van de factoren die de zogenaamde ‘oplosbaarheid’ beïnvloeden zijn de interacties tussen de componenten van de ontbinding.
De osmotisch proces Het is essentieel in biologische processen waarbij water het oplosmiddel is, vooral in die processen die gericht zijn op het handhaven van de water- en elektrolytenbalans in de levende wezens, het reguleren van het waterpeil in de cel of in het lichaam in het algemeen: zonder dit proces zou er geen regulering van vloeistoffen en absorptie van voedingsstoffen.
Voorbeelden van het osmoseproces
- Levende wezens eencellig leven in zoet water komen grote hoeveelheden water binnen.
- De opname van water door de wortels in plantaardige organismen, waardoor groei mogelijk is.
- Het verkrijgen van water uit epitheelcellen door de dikke darm.
- Splits een aardappel, plaats aan de ene kant een beetje suiker met water en aan de andere kant een bord met water. De aardappel werkt als een membraan en na een tijdje zal blijken dat de oplossing met suiker nu meer vloeistof bevat.
- Het hormoon ADH dat de reabsorptie van water door de verzamelbuis in de nieren mogelijk maakt.
- De eliminatie van zeer verdunde urine waarbij de vissen de maximale vloeistof uitstoten met een minimaal verlies van jij gaat uit.
- De verwijdering van water door zweet bij mensen.
- Filters om water te zuiveren werken met omgekeerde osmose, omdat ze gemaakt zijn met een materiaal die de doorgang van water toelaat, maar niet van grotere moleculen.
Volgen met:

