Voorbeeld van de wet van Charles
Fysica / / November 13, 2021
Charles' gaswet of wet van constante druk, is een van de gaswetten, uitgesproken door Gay-Lussac, die het werk van Jacques Charles uitbracht, gepubliceerd rond 20 around jaren ervoor.
De wet van Charles voorspelt het gedrag van een gasmassa wanneer de druk constant blijft en de temperatuur en het volume variëren.
De wet van Charles luidt als volgt:
Bij constante druk is het volume van een gas recht evenredig met de verandering in temperatuur.
Constante druk: verwijst naar het feit dat de druk die het gas uitoefent op de wanden van de container niet zal variëren gedurende de ervaring.
Volume: het is de bezette ruimte die het gas inneemt, in het algemeen wordt het beschouwd als een container met wanden die niet vervormen en waarvan het deksel werkt als een zuiger.
Temperatuur: Het is de toename of het verlies van warmte die het gas tijdens het experiment ondergaat. Als de temperatuur stijgt, neemt het volume toe. Als de temperatuur daalt, neemt ook het volume af.
Algebraïsch wordt de wet van Charles uitgedrukt met de volgende formule:

Waar:
V = gasvolume
T = gastemperatuur
k = evenredigheidsconstante voor die gasmassa.
Dit betekent dat voor een gegeven gasmassa, bij constante druk, de relatie tussen het volume en de temperatuurvariaties, hebben altijd dezelfde evenredigheidsrelatie, weergegeven door de constante k:

Dus zodra de constante is bepaald, kunnen we een van de andere waarden berekenen uit de andere bekende gegevens:
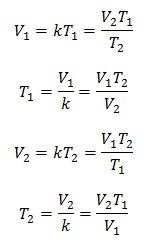
3 Voorbeelden van de wet van Charles toegepast op problemen:
voorbeeld 1: Bereken het nieuwe volume, als er zich in een container een gasmassa bevindt die een volume van 1,3 liter inneemt, bij een temperatuur van 280 K. Bereken het volume bij het bereiken van een temperatuur van 303 K.
V1 = 1,3 liter.
T1 = 280 K
V2 = ?
T2 = 303 K
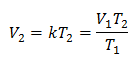
Vervangende waarden:
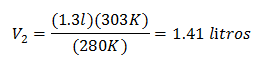
Het nieuwe volume bij 303 K is 1,41 liter.
Voorbeeld 2. Als we een gas hebben dat 2,4 liter inneemt bij 10 graden Celsius, bereken dan de eindtemperatuur, als het uiteindelijk 2,15 liter inneemt.
V1 = 2,4 l
T1 = 10 ° C = 283 K
V2 = 2,15 l
T2 = ?
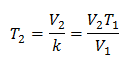
Vervangende waarden:
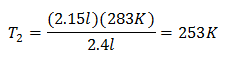
De nieuwe temperatuur is 253 K, wat gelijk staat aan -20°C.
Voorbeeld 3. We hebben een gas waarvan de begintemperatuur 328 K is, het uiteindelijke volume is 3,75 l en de verhoudingsconstante is 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
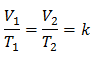
Vervangende waarden:
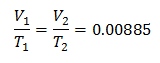
Om het beginvolume te kennen:
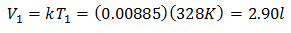
Het initiële volume is 2,90 l.
Om de eindtemperatuur te kennen:
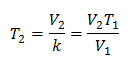
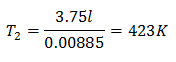
De eindtemperatuur zal 423 K zijn, wat gelijk is aan 150 ° C.