Definitie van moleculaire geometrie
Diversen / / January 11, 2022
Conceptuele definitie
Het is de structuur van een molecuul die de driedimensionale rangschikking bepaalt van de atomen waaruit het in de ruimte bestaat.

Chemisch ingenieur
Moleculaire geometrieën worden momenteel gedefinieerd op basis van de Theorie van afstoting van elektronische paren van de Valencia-laag (TRPECV). Deze theorie maakt het mogelijk om het gedrag te voorspellen chemisch van stoffen (specifiek covalent) en helpt bij het begrijpen van de verdeling elektronica, wat leidt tot geometrie van de molecuul. Dit stelt ons op zijn beurt in staat om veel van de eigenschappen die stoffen verkrijgen te begrijpen.
Deze theorie is gebaseerd op een reeks fundamentele pijlers die we zullen bekijken en vervolgens proberen hun te begrijpen sollicitatie oefening. In de eerste plaats worden gebonden en ongebonden (valentie)elektronen gezien als een zee van elektronen die, door dezelfde soort lading bezitten, stoten ze elkaar af, zodat ze altijd zo ver mogelijk van het centrale atoom van de molecuul.
Ten tweede vormt deze "zee" van elektronen of "elektronische wolk" gebieden met hoge elektronendichtheden, die zijn gevormd in bindingen, waarbij de elektronen worden gedeeld of in paren van elektronen die niet worden gedeeld. De gevormde bindingen kunnen op hun beurt enkelvoudig, dubbel of zelfs drievoudig zijn.
Eindelijk, voor beslissen moleculaire geometrie, is het erg handig om de Lewis-structuur te hebben, waar de hoeveelheid elektronendichtheden rond het centrale atoom wordt geteld en dit geeft indicatie van de naam van zijn geometrie en de vorm die het molecuul driedimensionaal aanneemt.
Opgemerkt moet worden dat deze dichtheden zo ver mogelijk uit elkaar zullen worden geplaatst om de meest stabiele structuur aan te nemen en waar er minder afstoting is. Zo wordt eerst de elektronische geometrie geïdentificeerd en daarna de moleculaire geometrie.
Zes niveaus van dichtheid
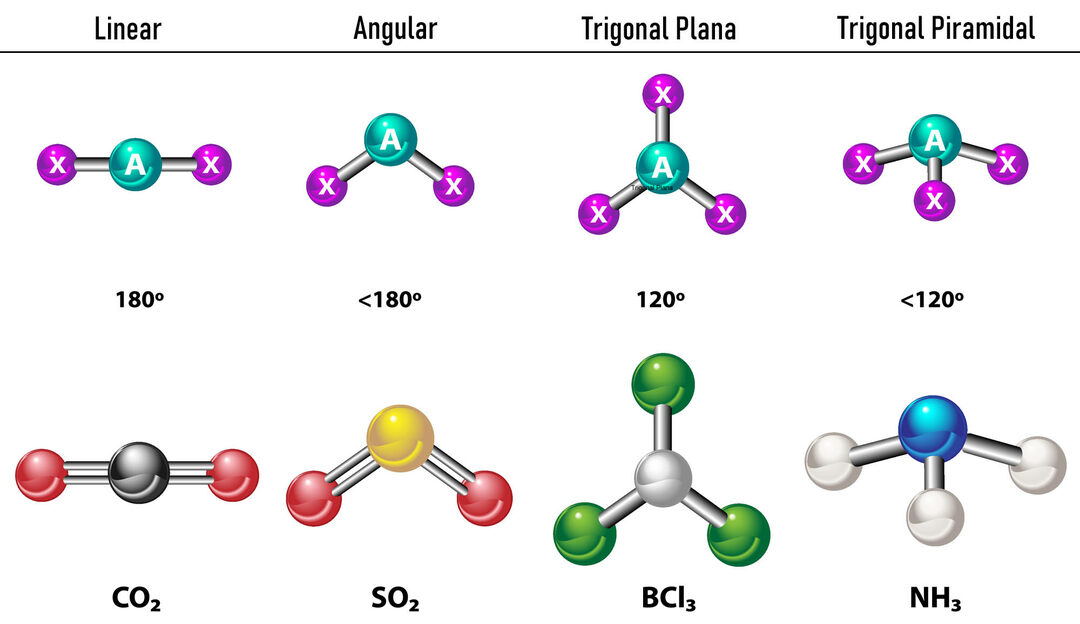
In het geval dat er twee elektronendichtheden rond het centrale atoom zijn, zullen de bindingen zo ver uit elkaar liggen tussen hen, dat wil zeggen 180º van elkaar, en daarom is hun elektronische geometrie lineair en moleculair ook lineair.
In het geval dat er drie elektronendichtheden rond het centrale atoom zijn, zijn er twee opties: drie bindingen of twee bindingen en één ongebonden paar. Als er drie bindingen zijn, is de elektronische geometrie Trigonaal plat, met 120º hoeken tussen bindingen en moleculaire geometrie heeft dezelfde naam. Nu, als er een niet-gebonden paar is, stoten ze elkaar af met meer intensiteit dat gebonden ladingen daarom de neiging hebben om bindingshoeken samen te drukken. De hoek tussen het vrije paar en elke binding is 120º en de elektronische geometrie is Trigonal Plane, terwijl de moleculaire geometrie Angular is.
In het geval dat er vier elektronendichtheden rond het centrale atoom zijn, is de elektronische geometrie tetraëdrisch. Als alle vier de elektronenparen gebonden zijn, valt hun moleculaire geometrie in naam samen met hun elektronische geometrie en is de bindingshoek 109,5º. Nu, als een van de paren vrij is, wordt de bindingshoek kleiner (107º) en is de moleculaire geometrie type Trigonale Piramide. Ten slotte, als twee vrije paren zijn en twee zijn gebonden, is de bindingshoek 104,5º terwijl de moleculaire geometrie wordt genoemd hoekig.
Wanneer de elektronendichtheden rond het centrale atoom vijf bedragen, wordt dit a. genoemd Trigonale bipiramide zijn elektronische geometrie. Als alle belastingen zijn gekoppeld, zijn er hoeken van 120ºC tussen de equatoriaal gelegen verbindingen en 90º tussen de axiale met de equiatoriale. Nu wordt moleculaire geometrie ook Trigonal Bipyramid genoemd, terwijl, met vier gekoppelde paren en één vrij paar, de moleculaire geometrie vervormd is en de bekende "rocker”, Daar is de naam die het verwerft Vervormde tetraëder. Terwijl, als twee van de vijf elektronenparen vrij zijn en drie van hen zijn gebonden, het een "T" -vormige geometrie heeft en de naam precies te danken is aan zijn structuur. Ten slotte, als het omgekeerd is, drie vrije paren en twee gebonden ladingen, is de moleculaire geometrie lineair.
Ten slotte zijn er zes elektronendichtheden rond het centrale atoom en wordt een octaëder gevormd, vandaar de naam in elektronische geometrie. Evenzo wordt de moleculaire geometrie genoemd als alle paren zijn gekoppeld. Als je vijf gekoppelde paren en één vrij paar hebt, is de moleculaire geometrie Square Base Pyramid. Als je vier gebonden paren en twee vrije paren hebt, is de moleculaire geometrie Vierkant plat.
Afbeelding: Zoete natuur
Onderwerpen in moleculaire geometrie