50 Voorbeelden van aldehyden en ketonen
Voorbeelden / / November 06, 2023
De aldehyden Zijn organische bestanddelen die in hun structuur een functionele carbonylgroep (= C = O) hebben die gekoppeld is aan een koolstofketen en een waterstofatoom. Bijvoorbeeld: methanal (ook wel formaldehyde genoemd), ethanal (ook wel acetaldehyde genoemd) en propanal (ook wel propaldehyde genoemd).
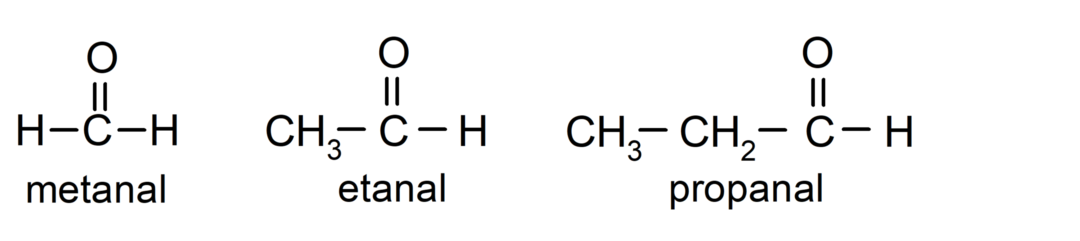
De ketonen Het zijn organische verbindingen die in hun structuur een carbonylgroep hebben die aan twee koolstofatomen is gekoppeld. Bijvoorbeeld: propanon (ook wel aceton genoemd), butanon en 2-pentanon.
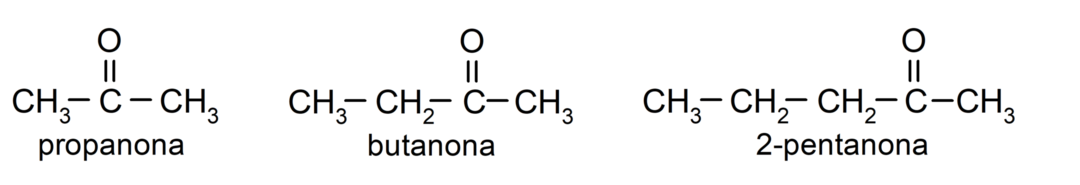
Verschillen tussen aldehyden en ketonen
De belangrijkste verschillen tussen aldehyden en ketonen zijn:
- Aldehyden hebben in hun structuur een functionele carbonylgroep die zich aan één uiteinde bevindt, terwijl bij ketonen de carbonylgroep zich op niet-terminale posities van hun bevindt structuur.
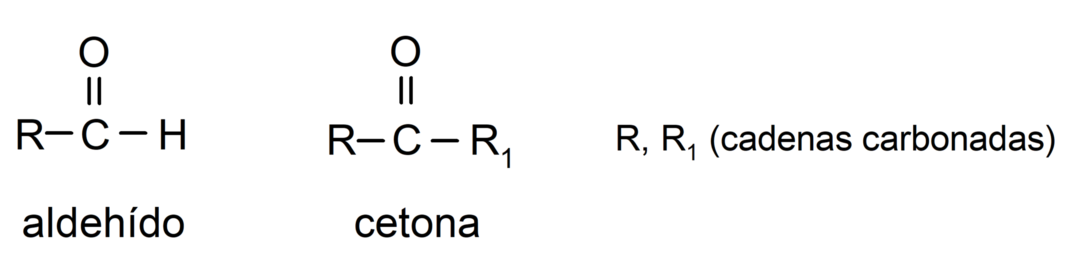
- Aldehyden worden geoxideerd door reactie met Tollens-reagens, waarbij metallisch zilver wordt gevormd. Ze oxideren ook tegen het reagens van Benedictus en vormen koperoxide. Ketonen worden door geen van beide reagentia geoxideerd.
- Aldehyden worden gereduceerd tot primaire alcoholen, terwijl ketonen worden gereduceerd tot secundaire alcoholen.
Fysieke eigenschappen
Fysische eigenschappen van aldehyden
De fysische eigenschappen van aldehyden zijn zeer divers omdat ze afhankelijk zijn van de samenstelling van de koolstofketen die aan de carbonylgroep is gekoppeld.
Sommige zijn:
- De aldehyden die het meest oplosbaar zijn in water zijn de aldehyden die kleiner van formaat zijn, zoals methanal en ethanal.
- Vluchtige aldehyden hebben een scherpe en zelfs irriterende geur.
- De carbonylgroep geeft ze polariteit.
- Ze hebben meestal hogere kookpunten dan chemische verbindingen met een vergelijkbare moleculaire grootte.
Fysische eigenschappen van ketonen
De fysische eigenschappen van ketonen zijn afhankelijk van hoe de koolstofketen die aan de carbonylgroep is gekoppeld, wordt gevormd.
- Veel ketonen hebben aangename geuren.
- De oplosbaarheid ervan in water hangt af van de grootte van de koolstofketen die aan de carbonylgroep is bevestigd. Hoe kleiner de koolstofketen, hoe beter oplosbaar het keton in water zal zijn.
- De carbonylgroep geeft ze een duidelijke polariteit.
- Ze hebben vrij hoge kookpunten vergeleken met chemische verbindingen met een vergelijkbare moleculaire grootte.
Chemische eigenschappen
Chemische eigenschappen van aldehyden
Onder de chemische eigenschappen van aldehyden kunnen we vinden:
Ze worden geoxideerd om het overeenkomstige carbonzuur te vormen, dat wil zeggen dat het gevormde zuur hetzelfde aantal koolstofatomen in de koolstofketen zal hebben als de aldehyde die er aanleiding toe gaf. Bijvoorbeeld:
- Oxidatie met Tollens-reagens (ammoniakzilvercomplex in basische oplossing, [Ag (NH3)2]+) uit ethanal produceert ethaanzuur en metallisch zilver.
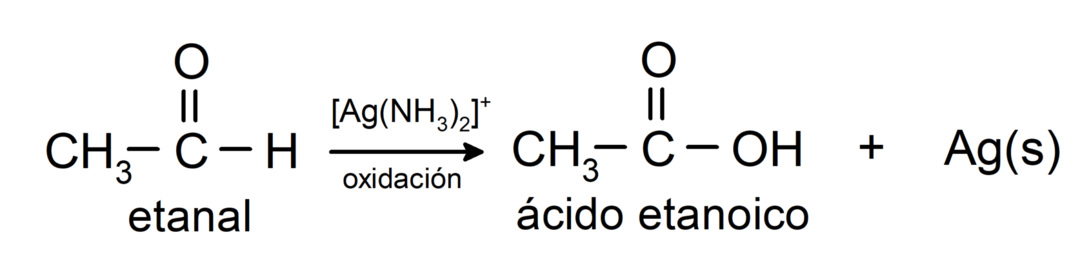
- Oxidatie met Benedict's reagens (alkalische oplossing van kopersulfaat) van ethanal produceert ethaanzuur en koperoxide.
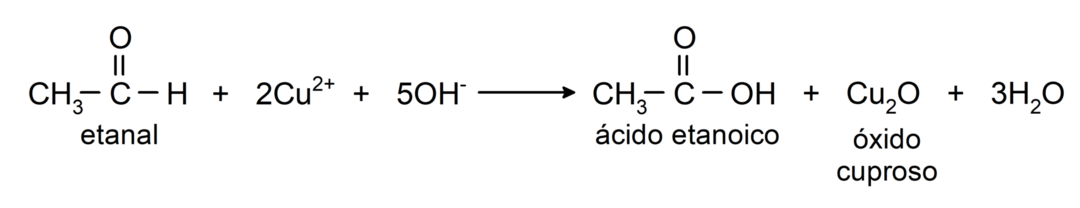
Ze ondergaan nucleofiele additiereacties, dat wil zeggen, toevoeging van een nucleofiel aan de carbonylgroep. Bijvoorbeeld:
- Toevoeging van blauwzuur om cyaanhydrinen of cyaanhydrinen te vormen.
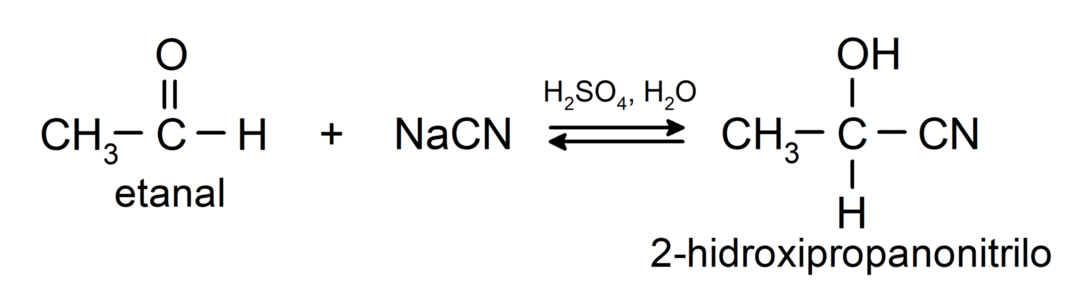
- In aanwezigheid van watervrije zuren worden alcoholen toegevoegd aan de carbonylgroep van aldehyden om acetalen en hemiacetalen te vormen.
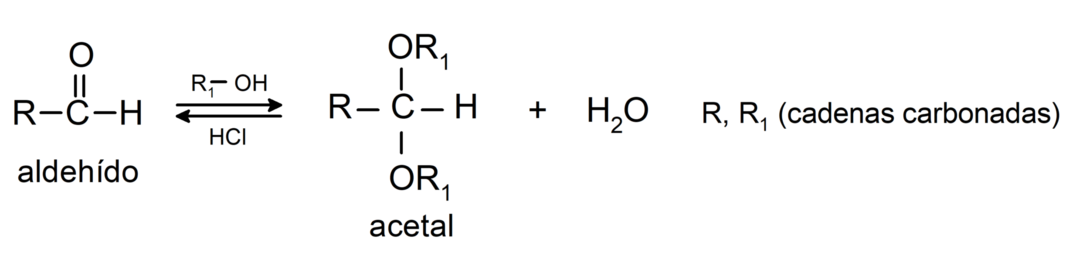
Ze ondergaan aldolcondensatiereacties. Bij deze reacties vindt de vereniging van twee aldehyden plaats in aanwezigheid van natriumhydroxide (NaOH) en de chemische verbinding het resultaat wordt aldol genoemd. Bijvoorbeeld:
- Condensatiereactie van ethanal in aanwezigheid van verdunde NaOH.
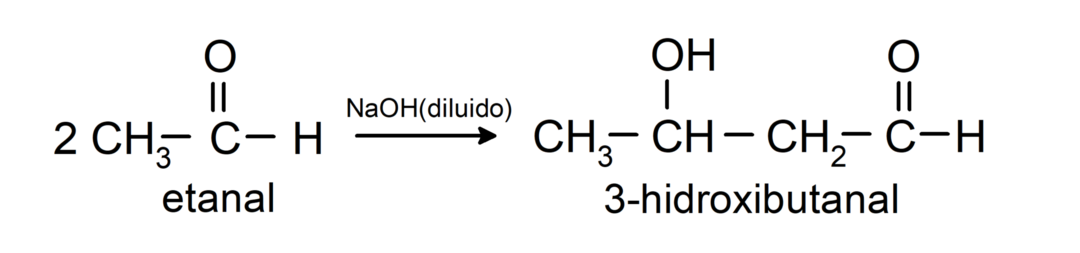
Ze worden gereduceerd tot primaire alcoholen. Aldehyden kunnen worden gereduceerd tot primaire alcoholen door katalytische hydrogenering of door reductie met natriumboorhydride (NaBH).4) en lithiumaluminiumhydride (LiAlH4).
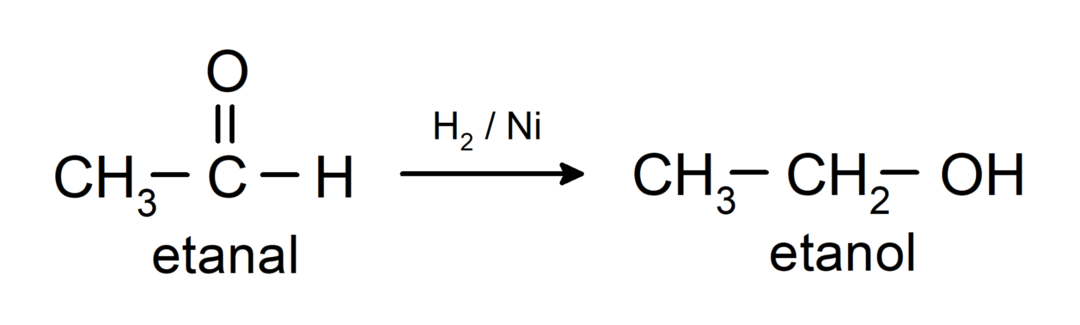
Chemische eigenschappen van ketonen
Onder de chemische eigenschappen van ketonen kunnen we het volgende vinden:
Ze ondergaan nucleofiele additiereacties. Bijvoorbeeld:
- Toevoeging van blauwzuur om cyaanhydrinen of cyaanhydrinen te vormen.
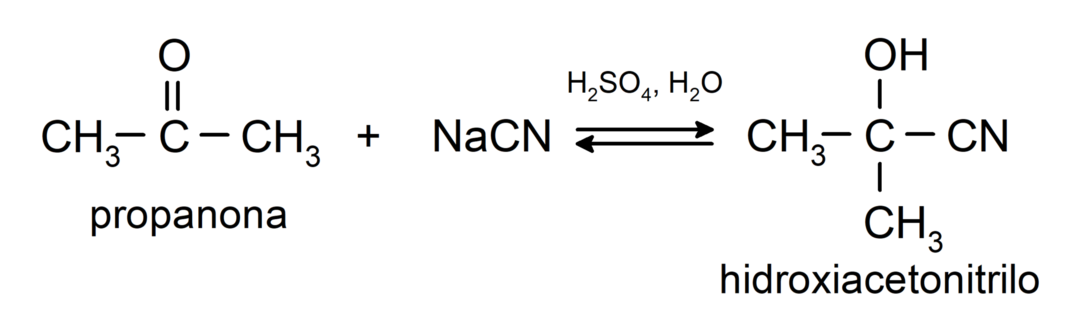
Ze voegen alcohol toe (in aanwezigheid van watervrije zuren) aan de carbonylgroep van ketonen om ketalen en hemiketalen te vormen. Bijvoorbeeld:
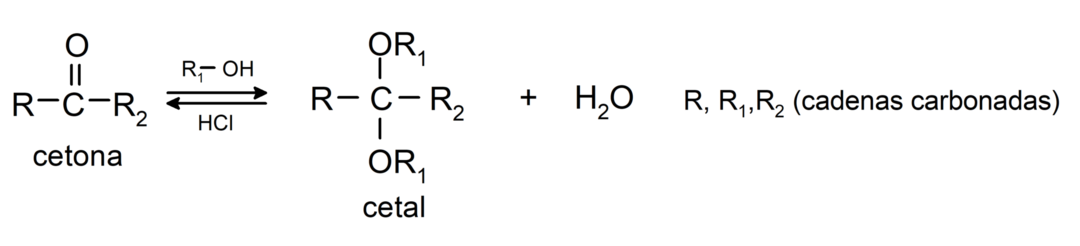
Ze ondergaan halogeneringsreacties. Ketonen met een alfawaterstof (α) reageren door deze waterstof te vervangen door halogenen (chloor (Cl), broom (Br), jodium (I), fluor (F)) in aanwezigheid van zure of basische katalysatoren. Substitutie vindt vrijwel uitsluitend plaats in koolstof α, dat wil zeggen de koolstof die aan waterstof is gebonden α. Bijvoorbeeld:
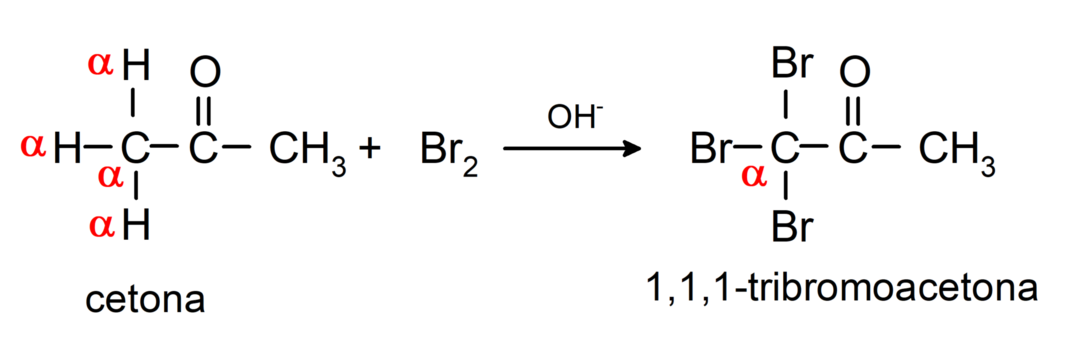
Ze worden gereduceerd tot secundaire alcoholen door katalytische hydrogenering of door reductie met natriumboorhydride (NaBH4) en lithiumaluminiumhydride (LiAlH4). Bijvoorbeeld:
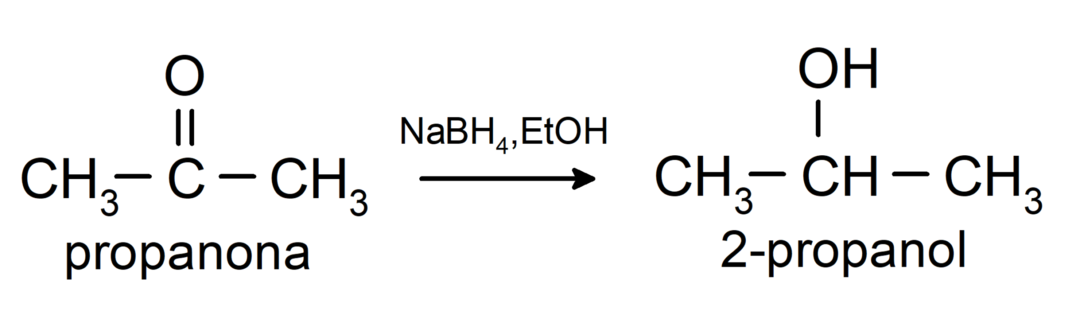
Ketonen worden niet geoxideerd door Tollens- en Benedict-reagentia.
Nomenclatuur van aldehyden
Volgens de regels opgesteld door de International Union of Pure and Applied Chemistry (IUPAC), Aldehyden worden genoemd met voorvoegsels die het aantal koolstofatomen in de keten aangeven. koolzuurhoudend. Het is niet nodig om de positie van de carbonylgroep te specificeren, aangezien deze zich altijd op positie één bevindt, aan het ene uiteinde van het molecuul. Bovendien wordt het achtervoegsel -al aan het einde van de aldehydenaam geschreven. Bijvoorbeeld:
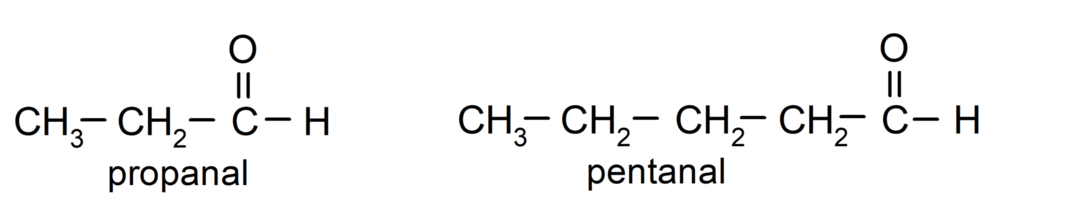
Als het aldehyde uit meerdere koolstofketens bestaat, dat wil zeggen vertakkingen heeft, wordt de koolstofketen met het grootste aantal koolstofatomen als hoofdketen gekozen. De andere ketens worden substituentgroepen genoemd en de positie van elke substituent wordt zo gekozen dat deze het kleinst mogelijke aantal in de keten inneemt. Bovendien beginnen de koolstofatomen te worden geteld vanaf het uiteinde met de carbonylgroep. Bijvoorbeeld:
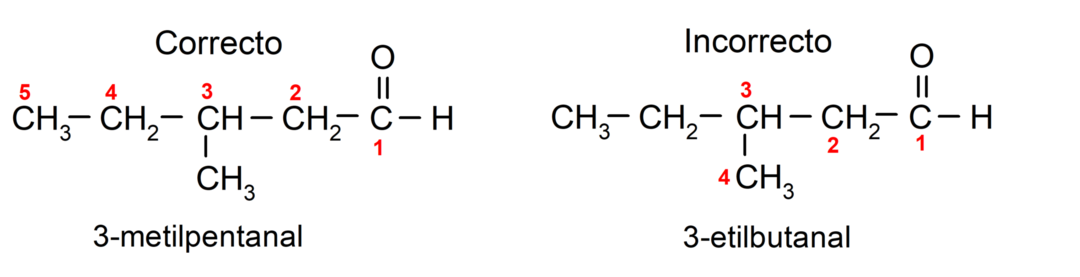
Aldehyden met twee carbonylgroepen worden genoemd met het achtervoegsel -dial. Bijvoorbeeld:
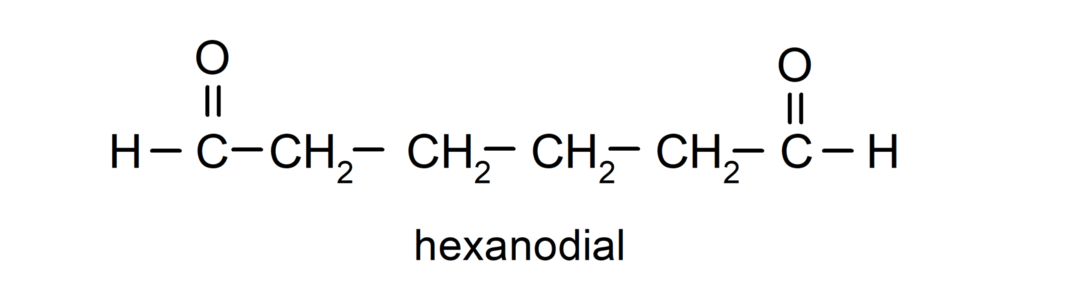
Ketonennomenclatuur
Volgens de International Union of Pure and Applied Chemistry (IUPAC) worden ketonen genoemd met voorvoegsels die het aantal koolstofatomen in de koolstofketen aangeven.
Aan de andere kant wordt de naam aceton geschreven met het achtervoegsel -one, voorafgegaan door een getal dat de positie van de carbonylgroep in de koolstofketen aangeeft. De locatie van de carbonylgroep moet zo worden gekozen dat deze overeenkomt met de laagst mogelijke nummering. Bijvoorbeeld:
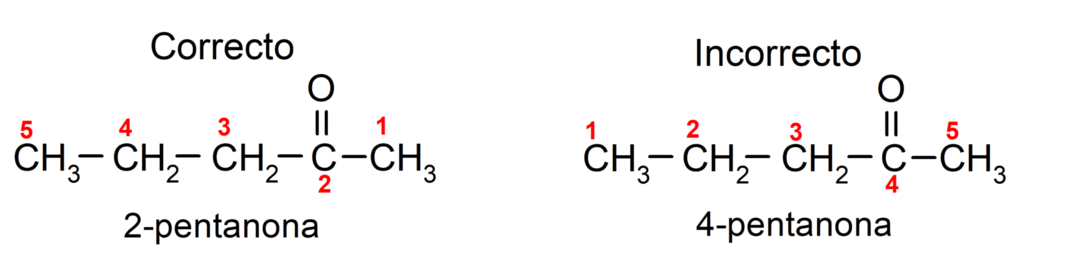
We kiezen voor een keton die is opgebouwd uit meerdere koolstofketens, dat wil zeggen met vertakkingen als hoofdketen, de koolstofketen met het grootste aantal koolstofatomen en die de groep bevat carbonyl. De rest van de ketens worden genoemd als substituentgroepen. Bijvoorbeeld:
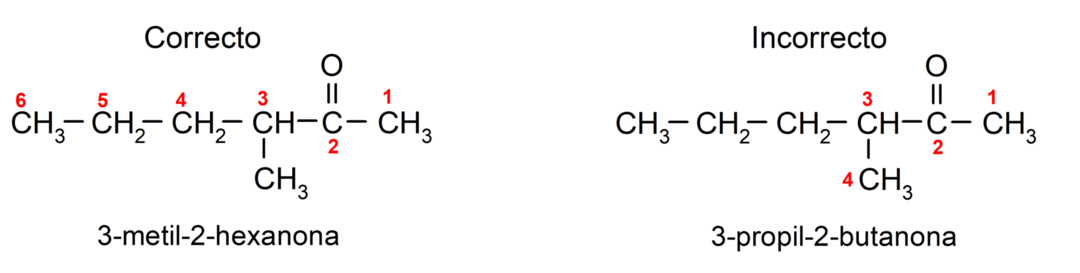
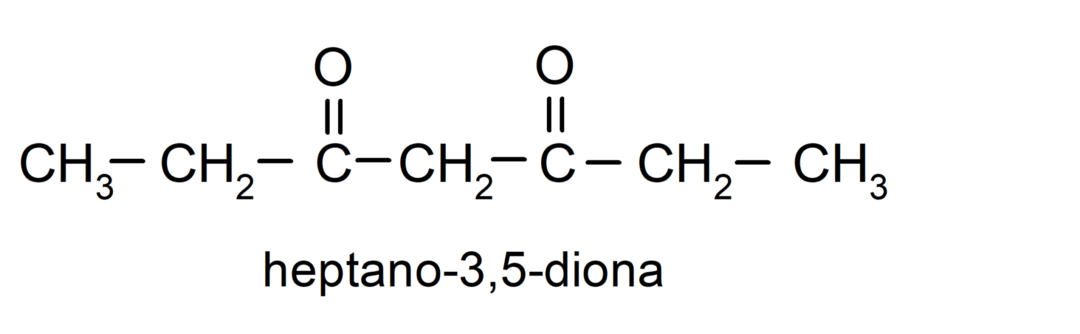
Er zijn ketonen die twee carbonylgroepen hebben, deze worden dionen genoemd. Bijvoorbeeld:
Voorbeelden van aldehyden
- methanaal (formaldehyde)
- ethanal (aceetaldehyde)
- propanal (propaldehyde)
- butanaal
- pentanaal
- hexanaal
- 3-broomcyclopentaancarbaldehyde
- cyclohexaancarbaldehyde
- benzaldehyde
- 4,4-dimethylpentanal
- 2-hydroxybutanal
- 2-hydroxy-2-methylbutanal
- 2,3-dimethylpentanal
- vijfhoekig
- 4-hydroxy-3-methoxybenzaldehyde
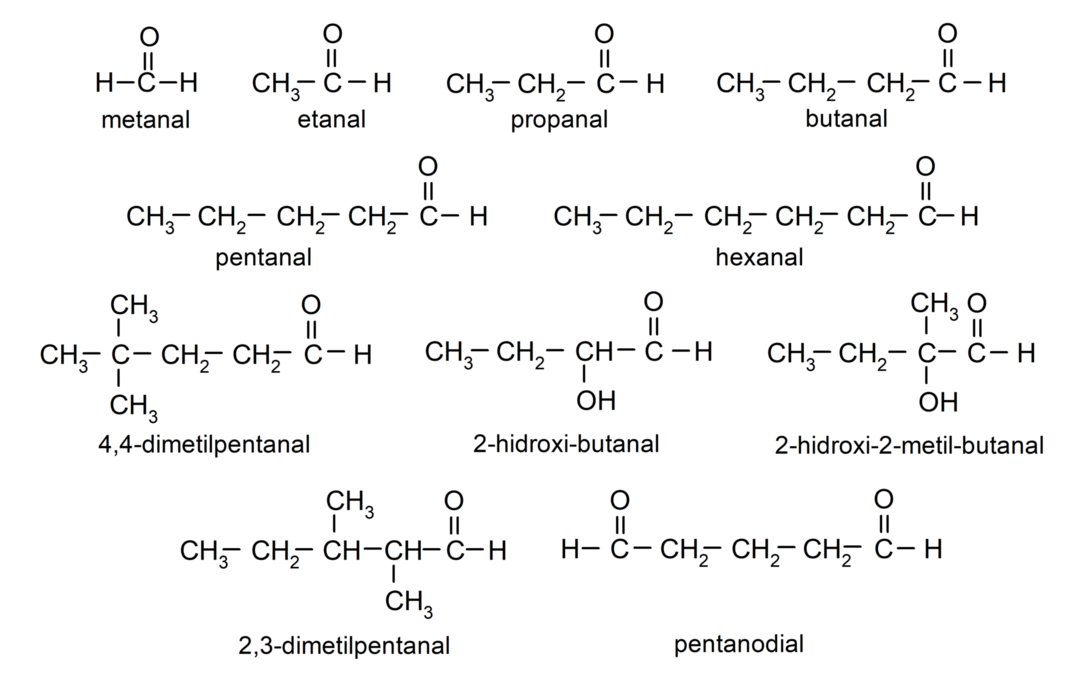
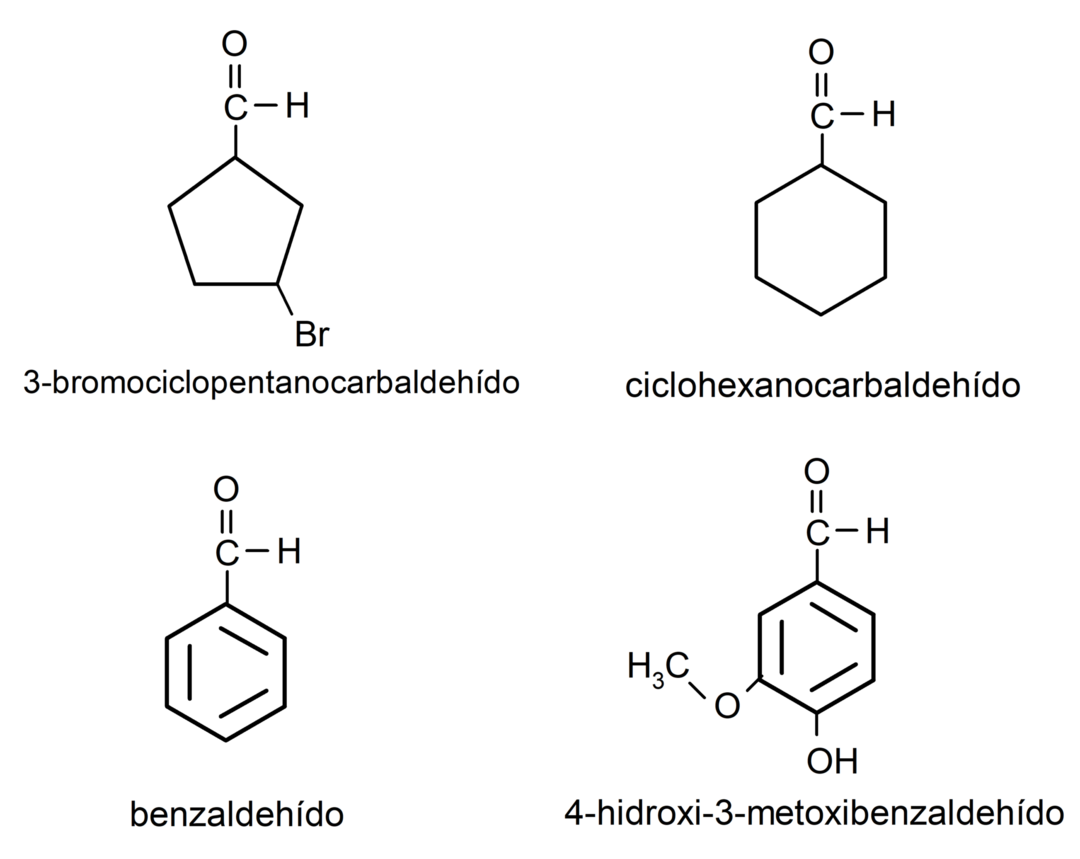
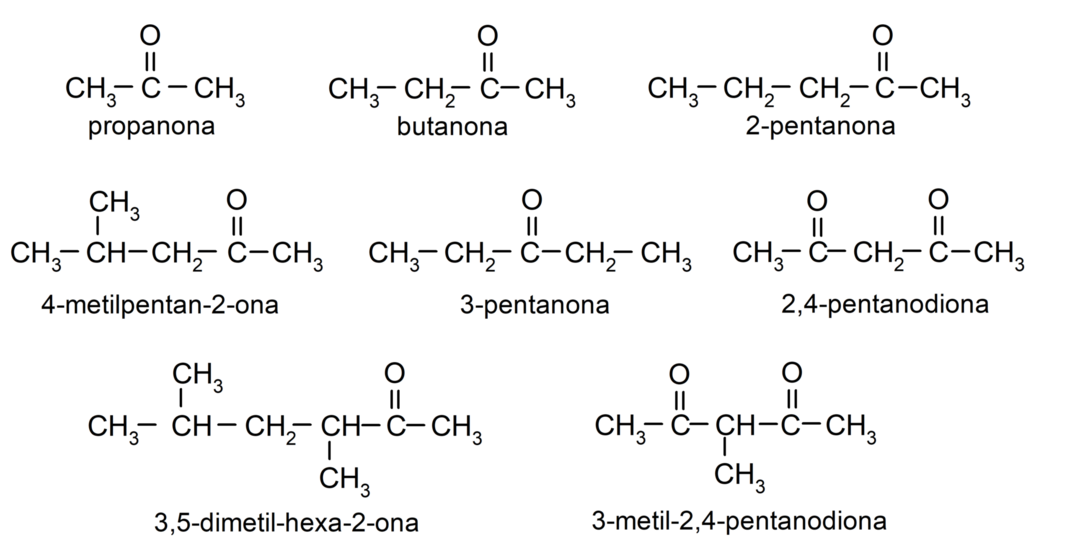
Voorbeelden van ketonen
- propanon (aceton)
- butanon
- 2-pentanon
- 4-methylpentaan-2-on
- 3-methylcyclohexanon
- cyclohexylmethylketon
- 3,4-dimethylhexaan-2-on
- ethylfenylketon
- 2,4-pentaandion
- cyclohexanon
- 3-pentanon
- 3-methyl-2,4-pentaandion
- 1-fenylpropanon
- cyclopentanon
- difenylketon
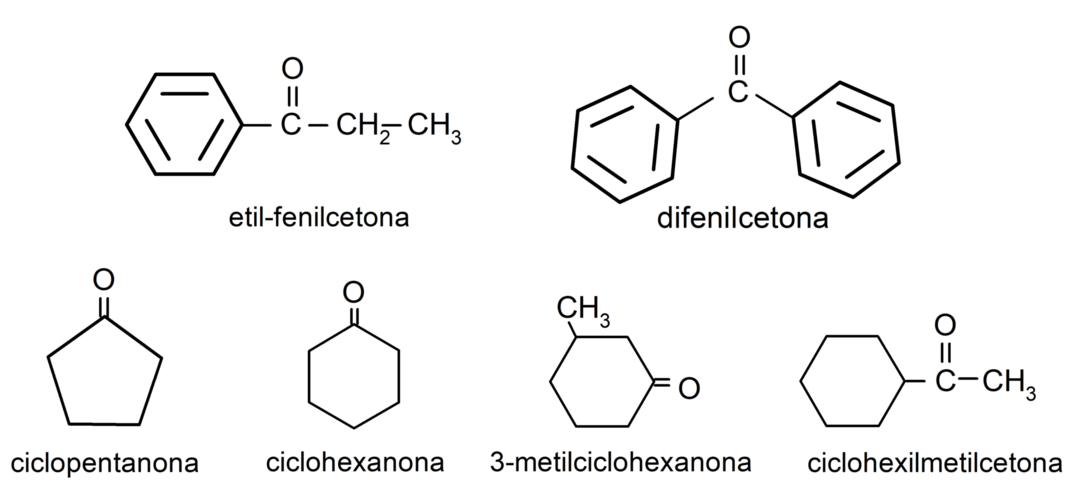
Gebruik van aldehyden in het dagelijks leven
Sommige toepassingen van aldehyden zijn:
- Ze worden gebruikt voor de productie van oplosmiddelen, verven, parfums, harsen en essences.
- Ze worden gebruikt als conserveermiddel in cosmetische producten, biologische monsters en lijken. Formaldehyde wordt voor deze doeleinden het meest gebruikt.
- Ze worden gebruikt voor de productie van kunststoffen, die de vervanging van metalen onderdelen in de auto-industrie mogelijk maken.
- Ze worden gebruikt als smaakstof voor sommige voedingsmiddelen.
- Ze worden gebruikt als ontsmettingsmiddelen.
- Ze zijn gebruikt om enkele explosieven te maken, zoals pentaerythritoltetranitraat (TNPE).
Gebruik van ketonen in het dagelijks leven
Sommige toepassingen van ketonen zijn:
- Ze worden gebruikt bij de productie van oplosmiddelen. Vooral aceton wordt veel gebruikt om verven en lakken te verwijderen.
- Ze worden gebruikt bij de vervaardiging van bepaalde rubbers en smeermiddelen.
- Ze worden gebruikt voor de productie van verven, lakken en vernissen.
- Ze worden gebruikt voor de productie van medicijnen en cosmetica.
Aldehyde- en ketontoxiciteit
- De aldehyden. Contact met aldehyden veroorzaakt irritatie van de huid, ogen en luchtwegen. Bovendien is blootstelling aan aldehyden in verband gebracht met ziekten zoals kanker, contactdermatitis en lever- en neurodegeneratieve ziekten. Formaldehyde wordt bijvoorbeeld door de WHO (Wereldgezondheidsorganisatie) beschouwd als een kankerverwekkende stof.
- ketonen. Herhaalde blootstelling aan ketonen kan schade aan het centrale zenuwstelsel veroorzaken. Dit kan leiden tot geheugenverlies, zwakte, spierpijn en krampen. Als de huid in contact komt met ketonen, kunnen er bovendien uitdroging en kloven ontstaan. Aan de andere kant, als ketonen worden ingeademd, treden irritatie van de luchtwegen en hoesten op.
Referenties
- Llorens Molina, JA. (2018). “Aldehyden en ketonen: enkele voorbeelden.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) “Het Tollens-reagens: van de identificatie van aldehyden tot hun gebruik in nanotechnologie. Historische aspecten en didactische toepassingen.”Vol. 111 Nee. 3. Koninklijke Spaanse Vereniging voor Chemie.
- William Bauer, Jr. (2000) «Methacrylzuur en derivaten»in Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- “Ze onthullen een nieuw toxiciteitsmechanisme in een groep kankerverwekkende verbindingen afkomstig van voeding en het milieu” (2022) In: www.conicet.gov.ar Beschikbaar in: https://www.conicet.gov.ar/ Geraadpleegd: 20 juni 2023.
Volgen met:
- Alcoholen
- Suikers
- Alkanen



