20 Voorbeelden van aminen
Voorbeelden / / November 06, 2023
De aminen Zijn organische chemische verbindingen ammoniakderivaten (NH3), waarbij ten minste één van de waterstofatomen van ammoniak is vervangen door een alkyl- of arylgroep, resulterend in de vorming van een aminogroep (-NH2, -NH-, -N=). Bijvoorbeeld:methylamine, ethylamine en propylamine.

Een alkylgroep is een substituent die ontstaat wanneer waterstof wordt verwijderd uit een verzadigde koolwaterstof. Op deze manier kan de koolstof waaruit die waterstof is gescheiden, zich aan een andere binden atoom. Bijvoorbeeld: methyl (CH3 -) en ethyl (CH3 – CH2 -).
Een arylgroep is een substituent afgeleid van een aromatische ring, zoals benzeen. Bijvoorbeeld: fenyl (C6H5 -)
- Zie ook: Amiden
Soorten aminen
Aminen kunnen worden geclassificeerd op basis van het aantal waterstofatomen gebonden aan de stikstof die zijn vervangen door functionele alkyl- of arylgroepen.
Volgens dit criterium zijn er:
- primaire aminen. Ze worden gevormd wanneer slechts één van de waterstofatomen van ammoniak wordt vervangen door een alkyl- of arylgroep. Bijvoorbeeld: ethylamine en 1-pentylamine.
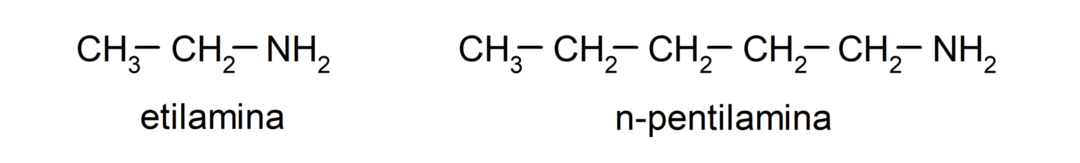
- secundaire aminen. Ze worden gevormd wanneer twee van de waterstofatomen van ammoniak worden vervangen door een alkyl- of arylgroep. Bijvoorbeeld: diethylamine en ethylmethylamine.
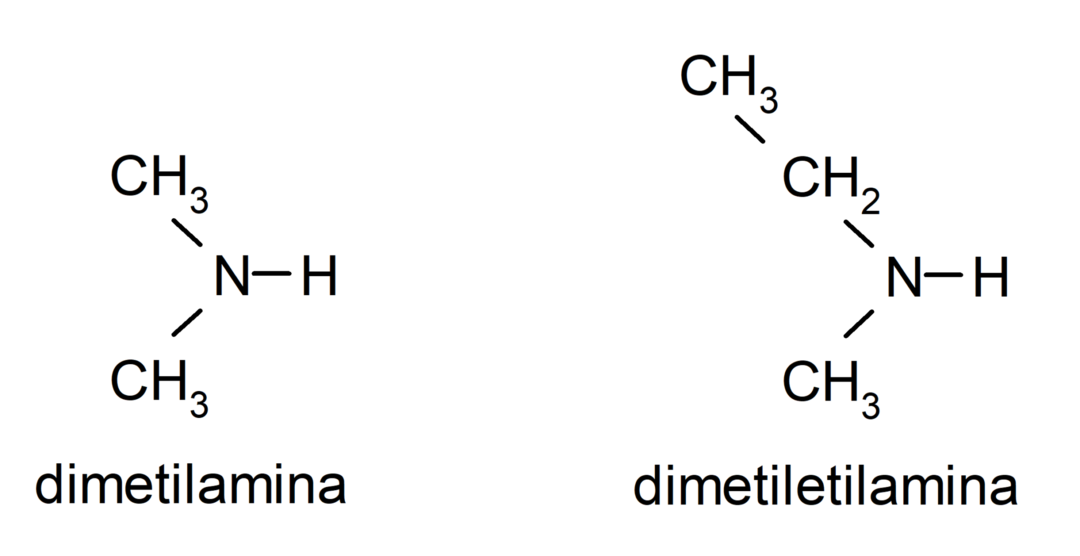
- Tertiaire aminen. Ze worden gevormd wanneer de drie waterstofatomen van ammoniak worden vervangen door een alkyl- of arylgroep. Bijvoorbeeld: trimethylamine en dimethylethylamine.
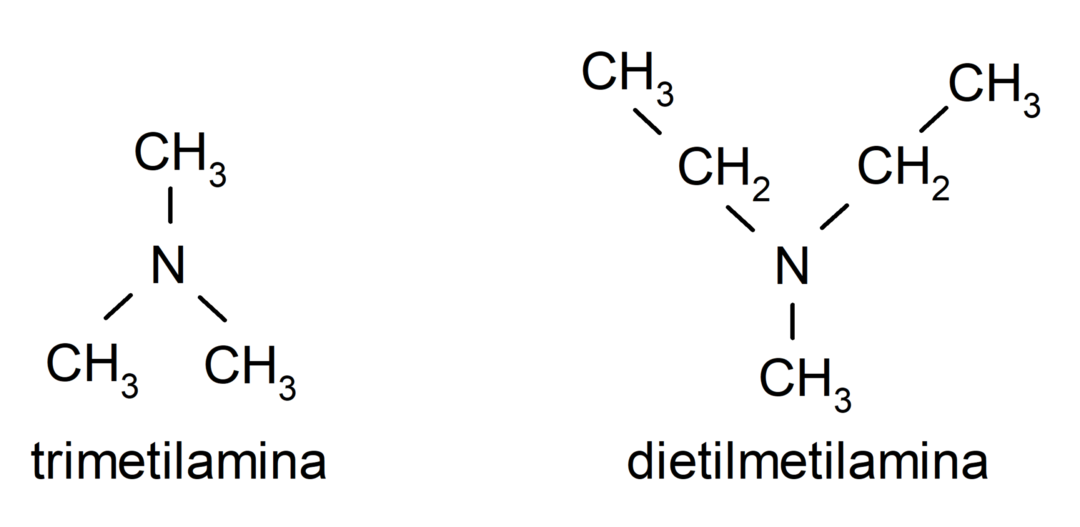
Aminen worden ook geclassificeerd op basis van het type groep dat aan de stikstof is gebonden. Volgens dit criterium zijn er:
- Alifatische aminen. Ze hebben alkylsubstituenten. Bijvoorbeeld: butylamine en diethylamine.

- aromatische aminen. Ze hebben arylsubstituenten. Bijvoorbeeld: fenylamine (aniline) en difenylamine.
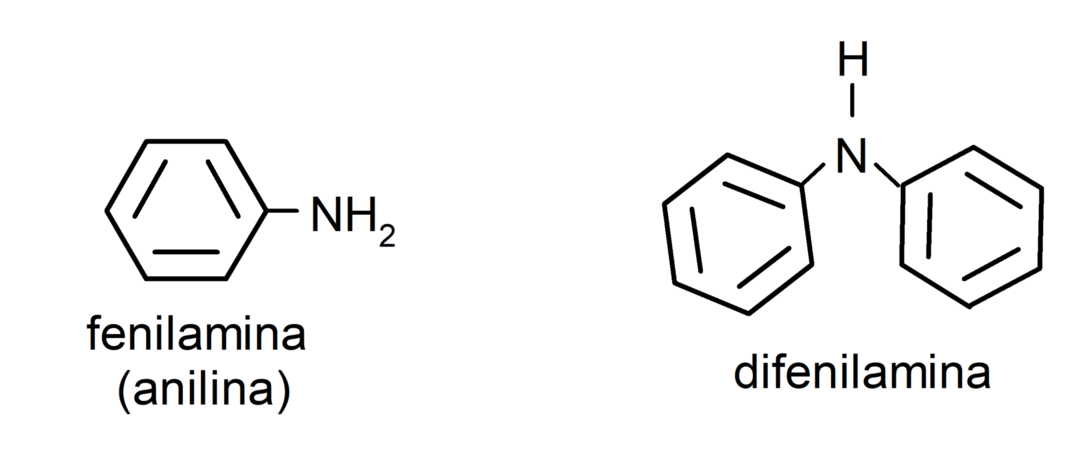
Nomenclatuur van aminen
Volgens IUPAC (International Union of Pure and Applied Chemistry) worden aminen genoemd volgens de volgende regels:
Voor de eenvoudigste aminen wordt elk van de substituenten van de waterstofgroepen die aan de ammoniakstikstof zijn gebonden, genoemd. Vervolgens wordt het woord “amine” aan het einde van de naam geplaatst.
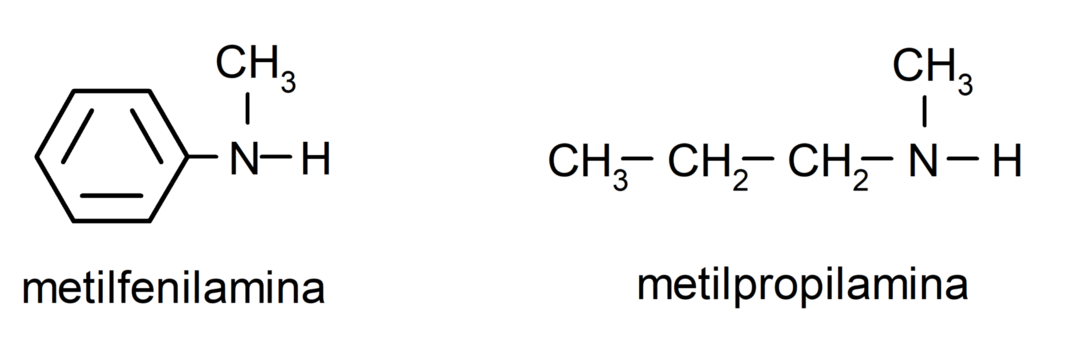
Voor aminen die meerdere koolstofketens bevatten (die op hun beurt andere substituenten hebben), wordt de koolstofketen die de aminogroep bevat als de belangrijkste gekozen. Bovendien wordt de positie van de aminogroep zo gekozen dat deze de kleinste positie in de koolstofketen inneemt Op basis van deze positie worden de substituenten ook zo gekozen dat ze de kleinst mogelijke positie innemen ketting.
Ten slotte worden ze genoemd met de naam van het overeenkomstige alkaan, alkeen of alkyn voor de hoofdketen, en wordt het amine-achtervoegsel geplaatst.
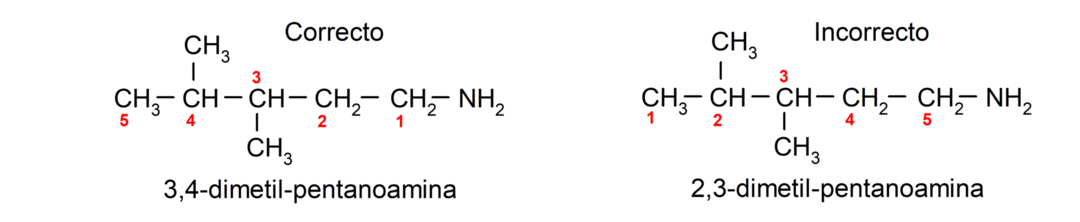
Als de koolstofketen meerdere aminogroepen bevat, worden ze gekozen op de positie die ze innemen in de kleinste combinatie van de nummering van hun posities. Daarnaast wordt de naam van het overeenkomstige alkaan, alkeen of alkyn geplaatst, gevolgd door de term die het aantal aminogroepen aangeeft, gevolgd door het achtervoegsel “amine”.

Fysische eigenschappen van aminen
De fysische eigenschappen van aminen hangen grotendeels af van hoeveel waterstofatomen die aan de stikstof zijn gebonden, zijn vervangen, en door welk type substituenten ze zijn vervangen.
- Oplosbaarheid. Over het algemeen zijn aminen beter oplosbaar in water dan de overeenkomstige verzadigde koolwaterstoffen. Bovendien zijn aminen met lange koolstofketens minder oplosbaar in water dan aminen met korte koolstofketens. Aan de andere kant zijn aromatische aminen niet oplosbaar in water.
- Kookpunt. Het kookpunt van aminen is hoger dan dat van alkanen met hetzelfde aantal koolstofatomen.
- Geur. De meeste aminen hebben een onaangename geur. Putrescine ruikt bijvoorbeeld naar rottend vlees en trimethylamine ruikt naar rottende vis.
Chemische eigenschappen van aminen
Enkele chemische eigenschappen van aminen zijn:
- Het zijn chemische basisverbindingen, dat wil zeggen, ze ondergaan reacties waarbij ze protonen accepteren volgens de Brønsted-Lowry-theorie. Bijvoorbeeld:
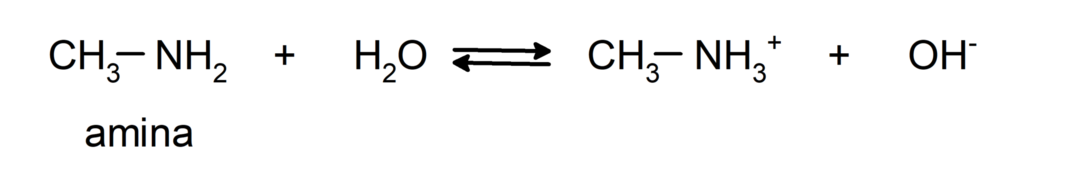
- Ze presenteren neutralisatiereacties met zuren waarin aminezouten worden gevormd. Bijvoorbeeld:

Voorbeelden van aminen
- methylamine
- ethylamine
- propylamine
- dimethylamine
- ethylmethylamine
- fenylamine (aniline)
- difenylamine
- methylpropylamine
- butaan-1,4-diamine
- sperma
- kadaver
- 3,5-dimethylaniline
- methylaniline
- amfetamine
- piperazine


Biologische functie van aminen
Aminen zijn in veel producten aanwezig levende wezens en voer verschillende functies uit. Sommige aminen, zoals epinefrine, noradrenaline, serotonine en dopamine, zijn neurotransmitters.
De aminogroep is een van de functionele groepen die aminozuren vormen, de fundamentele eenheden ervan eiwitten. Bovendien bevatten de stikstofbasen waaruit DNA en RNA bestaan aminogroepen.
Gebruik van aminen
Sommige toepassingen van aminen zijn:
- Ze worden gebruikt voor de productie van agrochemische en farmaceutische verbindingen.
- Ze worden gebruikt als katalysatoren bij de productie van polyurethaan.
- Vanwege hun dempende werking worden ze gebruikt om corrosie in waterige omgevingen te remmen.
- Ze worden gebruikt voor het zuiveren van gassen in energiecentrales en raffinaderijen.
- Ze worden gebruikt om schoonmaakproducten te maken.
- Ze worden gebruikt voor de productie van producten voor persoonlijke verzorging, omdat ze de schuimvorming in zeep en shampoo verbeteren.
Aminentoxiciteit
Inademing van aminen in hoge concentraties veroorzaakt vergiftiging, wat op zijn beurt een verhoogde bloeddruk en toevallen veroorzaakt. Bovendien kan contact met alifatische aminen in gasvormige toestand veroorzaakt irritatie aan de ogen en luchtwegen. Verschillende aminen veroorzaken bij contact huidverbranding.
Aromatische aminen zijn zeer giftig, maar omdat ze veel minder vluchtig zijn dan alifatische aminen, kan het contact ermee beter worden gecontroleerd.
Referenties
- Perez, C. R. C., & Jiménez-Colmenero, F. (2010). Biogene aminen: Toxicologisch belang. Elektron. J. Biomed., 3, 58-60.
- Fernández García, M., en Álvarez González, M. Á. (2005). Biogene aminen in voedingsmiddelen.
Volgen met:
- Alcoholen
- Aldehyden
- Ethylalcohol
- organische chemie

