30 Voorbeelden van alcoholen
Voorbeelden / / November 06, 2023
De alcoholen Zijn organische chemische verbindingen die in hun structuur de functionele hydroxylgroep (-OH) bevatten, gebonden aan een koolstofatoom (-C). De groep (- C – OH) wordt “carbinol” genoemd. Enkele voorbeelden van alcoholen zijn: methanol, ethanol en 1-propanol.
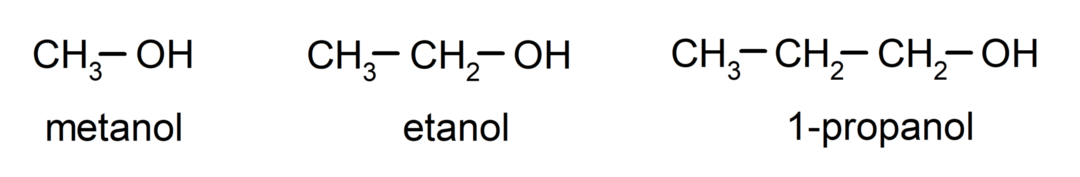
Alcoholen zijn chemische verbindingen die in het dagelijks leven op verschillende manieren worden gebruikt, omdat ze antibacteriële en antiseptische eigenschappen hebben. Aan de andere kant kunnen ze gevaarlijk zijn voor de menselijke gezondheid als ze ongecontroleerd worden ingenomen.
Evenzo kunnen niet alle alcoholen door mensen worden ingenomen.
- Zie ook: Aminen en ketonen
Soorten alcoholen
Afhankelijk van het aantal koolstofatomen waaraan het koolstofatoom waaraan de hydroxylgroep is bevestigd, is gehecht, kan een alcohol:
- Primaire alcohol. Het koolstofatoom waaraan de hydroxylgroep is bevestigd, is ook gebonden aan een enkel koolstofatoom. Bijvoorbeeld:
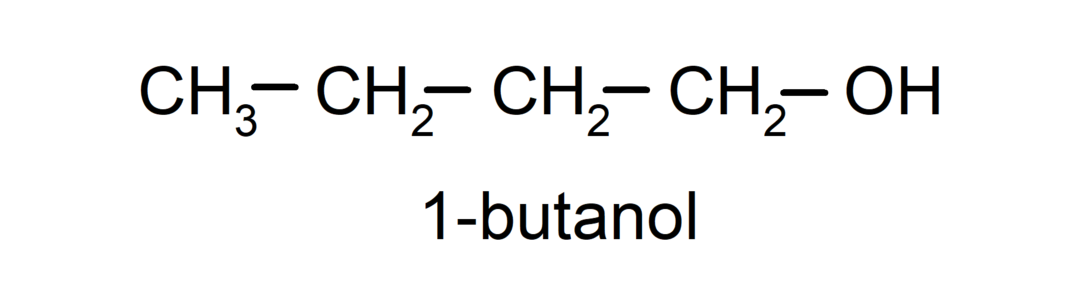
- Secundaire alcohol. Het koolstofatoom waaraan de hydroxylgroep is bevestigd, is ook gebonden aan twee andere koolstofatomen. Bijvoorbeeld:
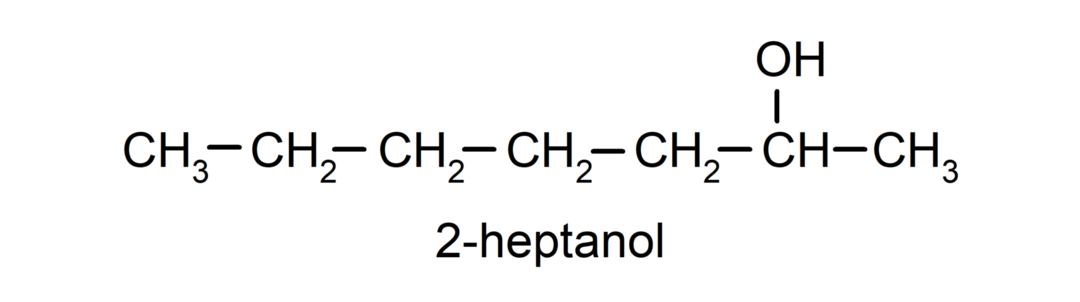
- Tertiaire alcohol. Het koolstofatoom waaraan de hydroxylgroep is bevestigd, is ook gebonden aan drie koolstofatomen. Bijvoorbeeld:
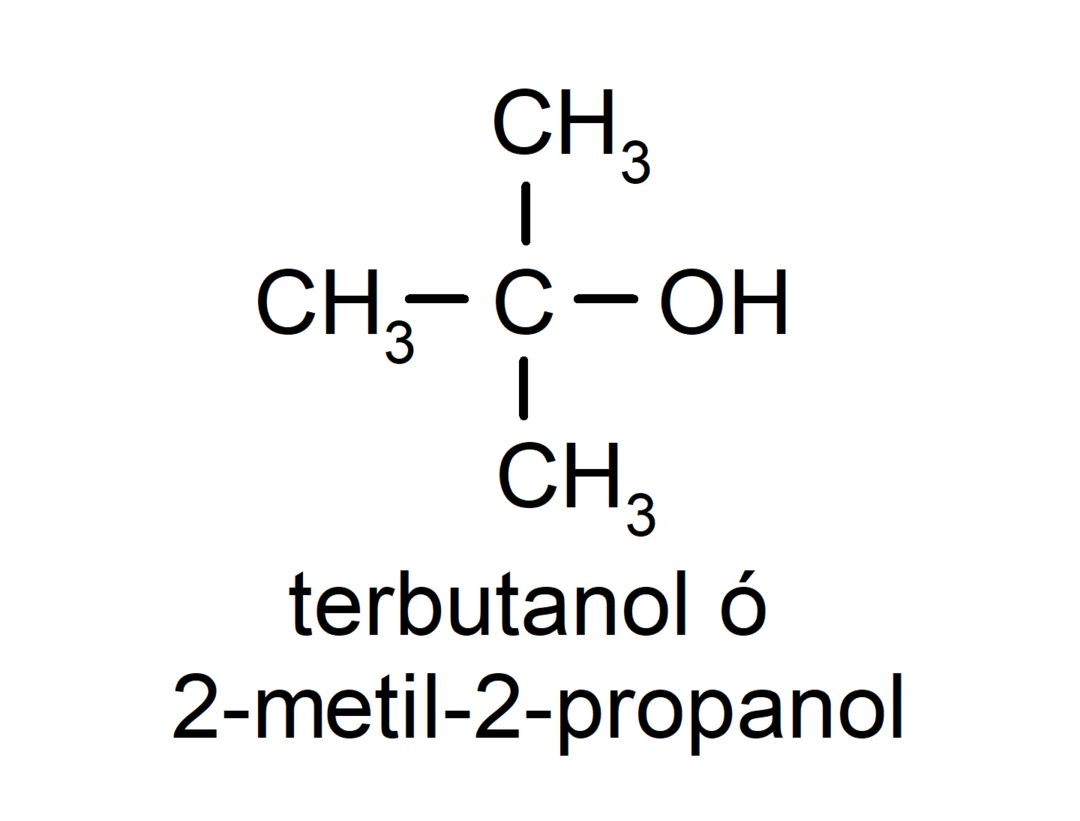
Afhankelijk van het aantal hydroxylgroepen dat het heeft, kan een alcohol zijn:
- Diol. Het heeft twee hydroxylgroepen in zijn structuur. Bijvoorbeeld:
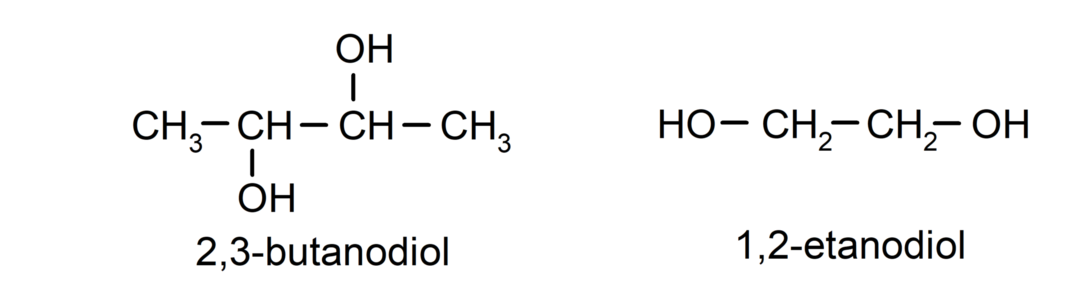
- Triol. Het heeft drie hydroxylgroepen in zijn structuur. Bijvoorbeeld:
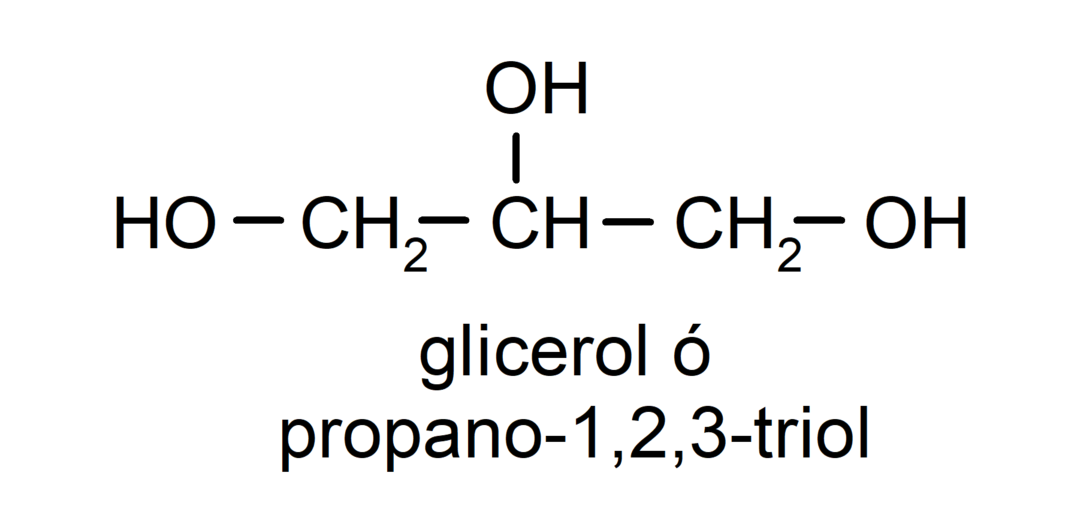
- Polyalcohol. Het heeft veel hydroxylgroepen in zijn structuur. Bijvoorbeeld:
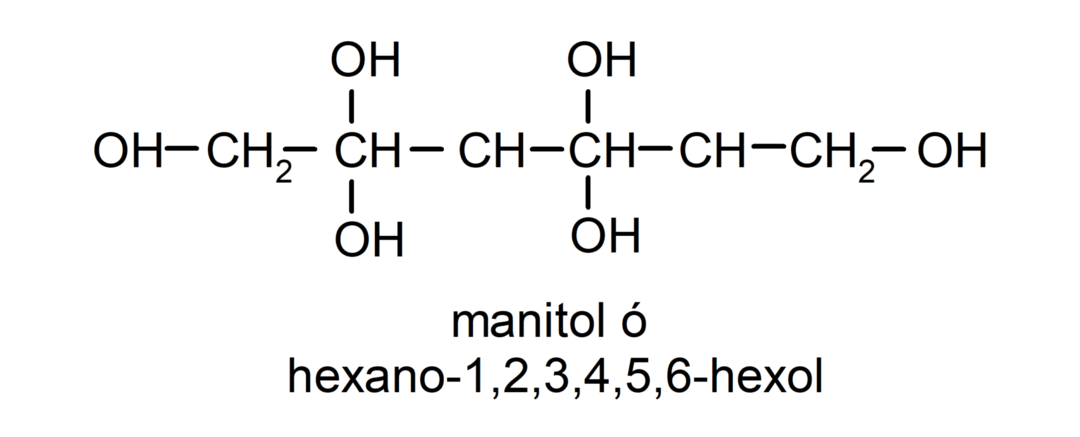
Fysische eigenschappen van alcoholen
Enkele van de fysieke eigenschappen van alcoholen zijn:
- Kookpunt. Het kookpunt van alcoholen is vrij hoog vanwege de aanwezigheid van de hydroxylgroep, die de vorming van waterstofbruggen mogelijk maakt. Bovendien geldt dat hoe meer functionele hydroxylgroepen aanwezig zijn in de koolstofketen, hoe hoger de waarde Kookpunt van alcoholen.
- Polariteit. Alcoholen zijn behoorlijk polaire verbindingen.
- Oplosbaarheid. Alcoholen met een laag molecuulgewicht zijn oplosbaar in water. Aan de andere kant, hoe groter de koolstofketen van alcoholen, hoe lager hun oplosbaarheid in water. Bovendien geldt dat hoe meer hydroxylgroepen alcoholen hebben, hoe groter hun oplosbaarheid in water is.
- Staat van aggregatie. De meeste alcoholen zijn vloeibaar bij kamertemperatuur (25ºC) en hebben karakteristieke geuren.
Chemische eigenschappen van alcoholen
Enkele van de chemische eigenschappen van alcoholen zijn:
- Alcoholen gedragen zich als zuren en basen.. Hun gedrag als zuren is te zien in reacties met actieve metalen, waarbij waterstofgas vrijkomt en alkoxiden worden gevormd.

Hun gedrag als basen is te zien in reacties zoals de reactie van methanol met waterstofbromide om methyloxoniumbromide te vormen.
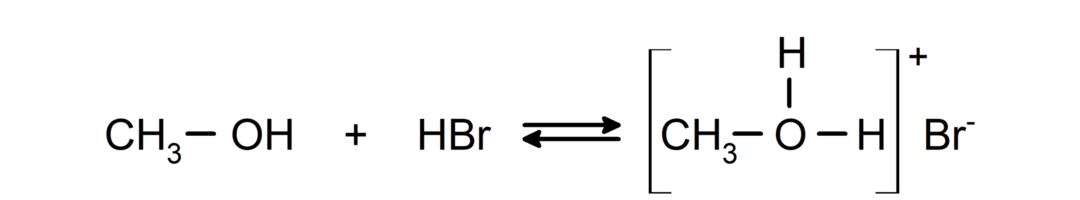
- Alcoholen ondergaan halogeneringsreacties. Ze reageren met waterstofhalogeniden om alkylhalogeniden te vormen.
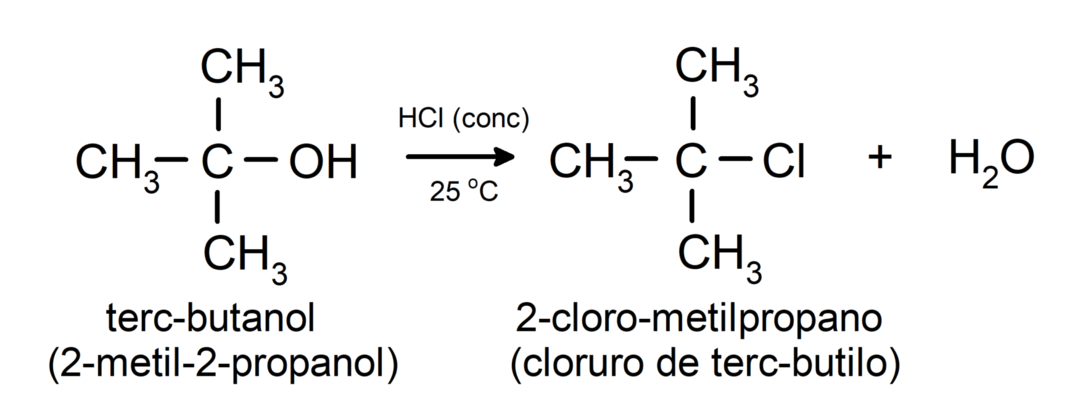
-
Alcoholen ondergaan oxidatiereacties wanneer ze reageren met bepaalde oxiderende verbindingen. De producten van oxidatiereacties zijn afhankelijk van het type alcohol dat reageert, dat wil zeggen of het primair, secundair of tertiair is.
Oxidatie van primaire alcohol om aldehyde of carbonzuur te vormen.
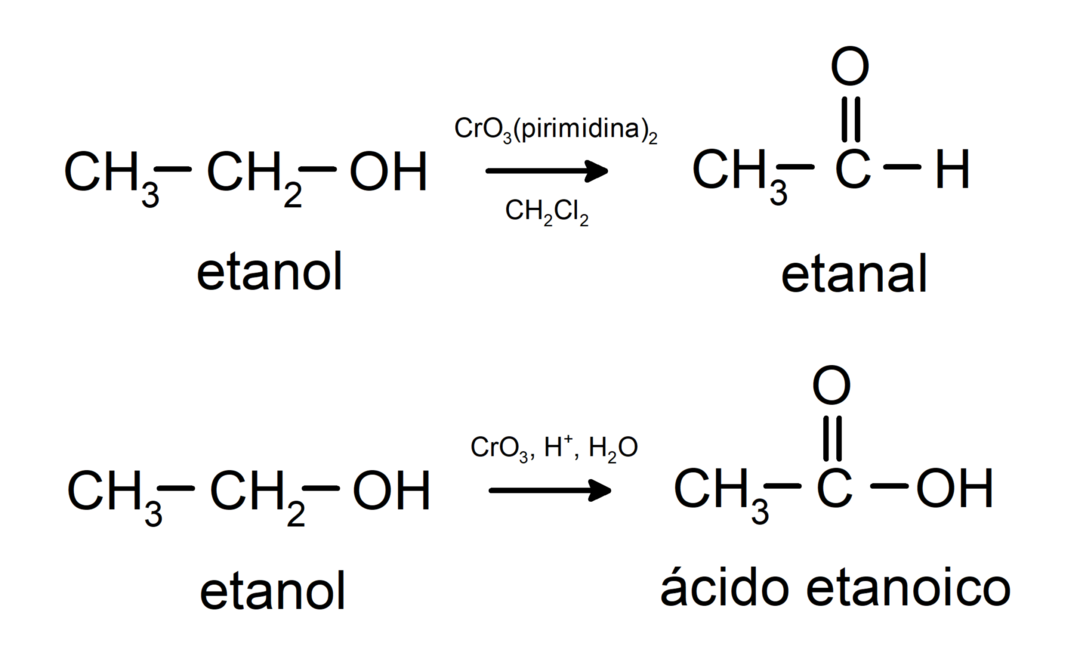
Oxidatie van secundaire alcohol om keton te vormen.
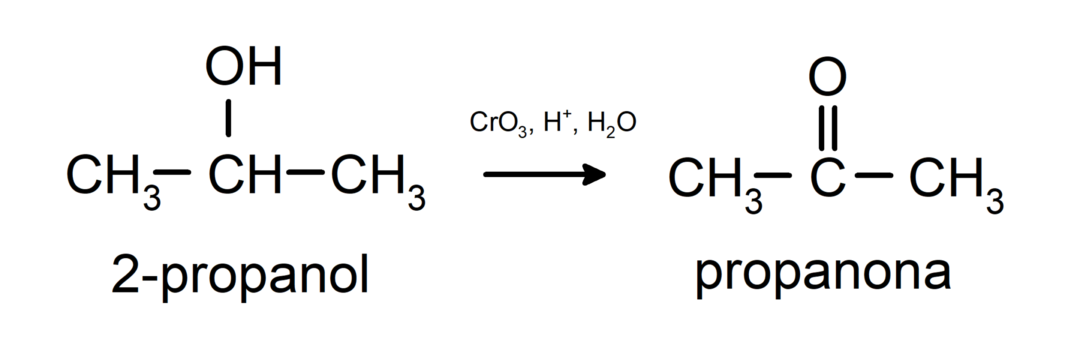
Tertiaire alcoholen oxideren niet met gewone oxidatiemiddelen. Met zeer sterke oxidatiemiddelen kunnen ze worden omgezet in alkenen, die vervolgens kunnen worden geoxideerd.
Alcoholen met twee hydroxylgroepen op aangrenzende koolstofatomen worden geoxideerd met loodtetraacetaat om twee ketonen te vormen.
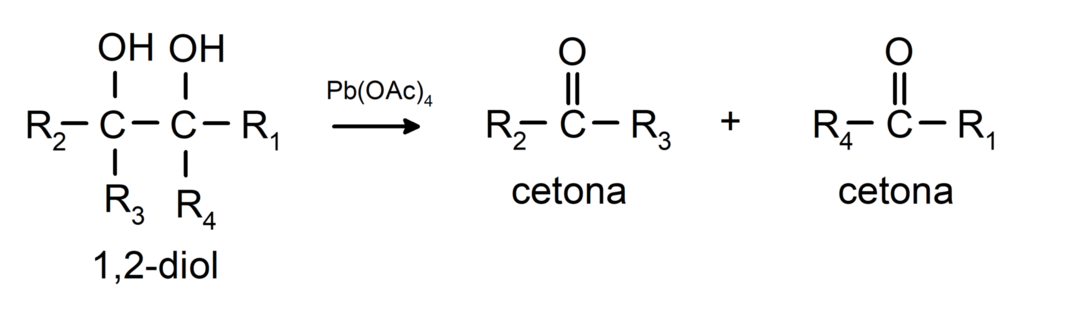
- Alcoholen ondergaan dehydrogeneringsreacties. Deze reacties vinden alleen plaats met primaire en secundaire alcoholen, die bij blootstelling aan hoge temperaturen in aanwezigheid van katalysatoren waterstofatomen vrijgeven.
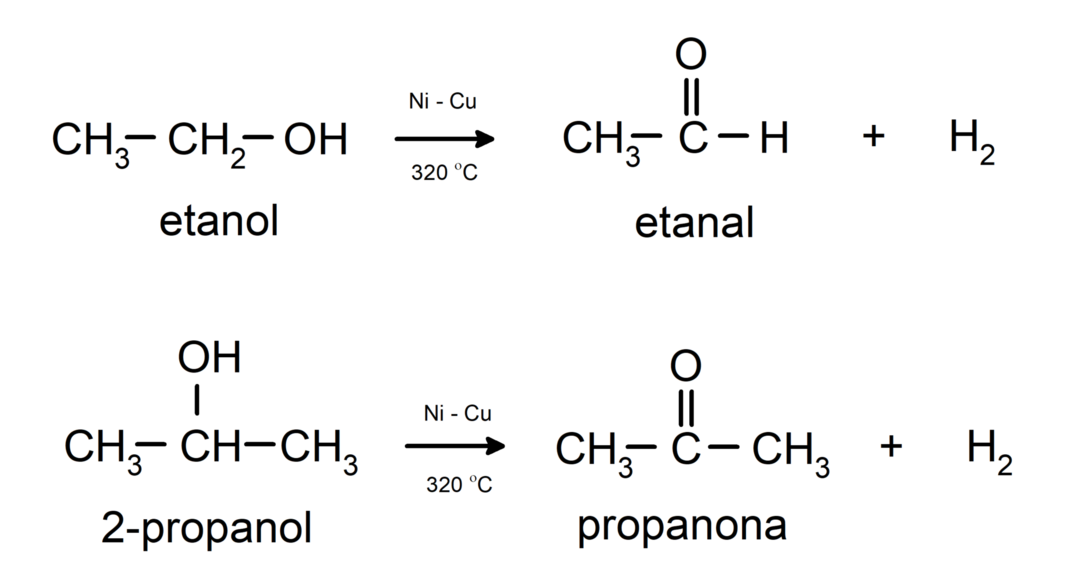
- Alcoholen ondergaan uitdrogingsreacties. Alcoholen drogen uit en vormen de overeenkomstige alkenen. Deze reactie vindt plaats in aanwezigheid van zuur en tussenliggende temperaturen.
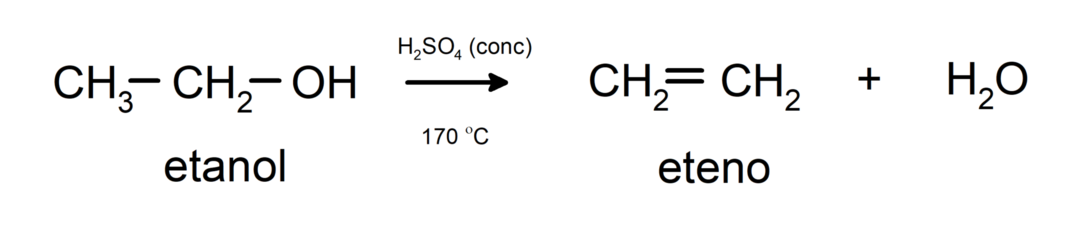
Alcoholnomenclatuur
Volgens de nomenclatuur opgesteld door de IUPAC (International Union of Pure and Applied Chemistry) worden alcoholen genoemd volgens de volgende regels:
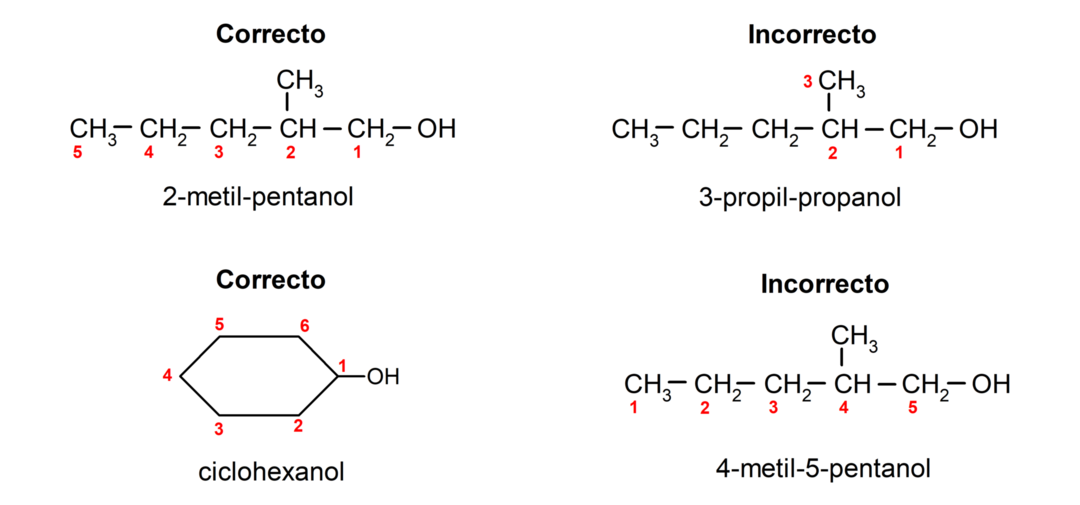
- De positie van de hydroxylgroep wordt gekozen rekening houdend met het feit dat deze het laagst mogelijke aantal in de koolstofketen inneemt. Als de structuur van de alcohol cyclisch is, wordt rekening gehouden met de 1-positie op het koolstofatoom waaraan de hydroxylgroep is bevestigd en wordt het voorvoegsel cyclo- gebruikt om deze te benoemen.
- De naam van de alcohol wordt geschreven met voorvoegsels die het aantal atomen in de koolstofketen aangeven, en bovendien wordt het achtervoegsel -ol geplaatst.
- Als de structuur van de alcohol vertakkingen heeft, wordt de langste keten die ook de hydroxylgroep bevat gekozen als de belangrijkste koolstofketen.
Volgens de traditionele nomenclatuur worden alcoholen genoemd door het woord ‘alcohol’ te schrijven en vervolgens de naam van de alcohol. alkaan dat overeenkomt met de koolstofketen, maar in plaats van het -aan-uiteinde van het alkaan te gebruiken, het einde -yllisch.
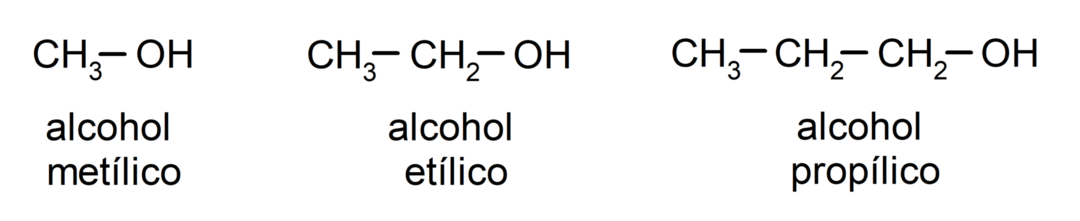
Voorbeelden van alcoholen
- methanol
- ethanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-ethylhexan-2-ol
- glycerol
- fenol
- 2-methyl-2-butanol
- 1,2-ethaandiol
- 1,5-heptadieen-3-ol
- 3-methyl-2-butanol
- benzylmethanol
- 3-pentanol
- 2-methylfenol
- 1,2-dihydroxyfenol
- cyclohexanol
- 1-fenylethanol


Gebruik van alcoholen
De meest voorkomende toepassingen van alcoholen zijn:
- Ze worden gebruikt als ontsmettingsmiddel en antisepticum, omdat ze de groei van sommige soorten tegenhouden micro-organismen of vernietig ze. Ethanol en isopropylalcohol worden hiervoor het meest gebruikt.
- Ze worden gebruikt bij de synthese van verschillende chemische bestanddelen. Methanol wordt bijvoorbeeld gebruikt om methanal (formaldehyde) te verkrijgen.
- Ze worden gebruikt om antivries te produceren. Methanol is een van de meest gebruikte middelen voor dit doel.
- Ze worden gebruikt als oplosmiddelen in de farmaceutische industrie. Ethanol is een van de meest gebruikte in deze zin.
- Ze worden gebruikt als oplosmiddel voor lakken, kleurstoffen en inkten. Hiervoor wordt veel methanol gebruikt.
- Ze worden gebruikt als brandstof en er is een belangrijke tendens om het gebruik ervan gedeeltelijk te vervangen fossiele brandstoffen door het gebruik van bio-ethanolbrandstof.
- Ze worden gebruikt om harsen te maken. Fenol wordt in deze zin gebruikt.
Gevaren van alcoholgebruik
Hoewel alcoholgebruik tegenwoordig sociaal geaccepteerd is, leidt het misbruik van deze stof tot afhankelijkheid en verslaving.
Ethanol is de alcohol die aanwezig is in alcoholische dranken en die bij overmatig gebruik een effect heeft op de gezondheid cognitieve vaardigheden, en kan hart- en vaatziekten, levercirrose en kanker.
Bovendien, wanneer de mate van alcoholintoxicatie is bereikt, dat wil zeggen een staat van dronkenschap, als de dosis van het alcohol te hoog is, kan een alcoholisch coma optreden, wat kan leiden tot ademhalingsverlamming en zelfs de dood. dood.
Referenties
- T. NAAR. Geissman. (1974) “Principes van de organische chemie” tweede editie. Redactie Reverté, S.A. ISBN-nummer: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E., & Valdez-Montero, C. (2017). Alcoholgebruik als probleem voor de volksgezondheid. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T., & Boyd, R. N. (1998). Organische chemie. Pearson-onderwijs.
- Weininger, S. J., & Stermitz, F. R. (1988). Organische chemie. Ik keerde om.
Volgen met:
- Ethylalcohol
- Brandstoffen
- organische chemie
