30 Voorbeelden van binaire verkopen
Voorbeelden / / November 09, 2023
De binaire zouten (neutrale zouten) worden gevormd wanneer een metaal en een niet-metaal samenkomen. Zijn chemische bestanddelen bestaat uit slechts twee chemische elementen. Bijvoorbeeld: natriumchloride (NaCl) en kaliumbromide (KBr).
- Zie ook: Metalen en niet-metalen
Voorbeelden van binaire zouten
- Natriumchloride (NaCl)
- IJzer(II)chloride (FeCl2)
- IJzer(III)chloride (FeCl3)
- Kobalt(II)sulfide (CoS)
- Kobalt(III)sulfide (Co2Ja3)
- Lood(II)sulfide (PbS)
- Lood(IV)sulfide (PbS2)
- Calciumchloride (CaCl2)
- Natriumfluoride (NaF)
- Lithiumchloride (LiCl)
- Strontiumchloride (SrCl2)
- Bariumchloride (BaCl2)
- Aluminiumchloride (AlCl3)
- Magnesiumsulfide (MgS)
- Rubidiumchloride (RbCl)
- Calciumbromide (CaBr2)
- Kaliumsulfide (K2S)
- Magnesiumbromide (MgBr2)
- Zinksulfide (Zn2S)
- Lithiumbromide (LiBr)
- Nikkelchloride (NiCl2)
- Uranium(III)chloride (UCl3)
- Zilverbromide (AgBr)
- Zilverjodide (AgI)
- Kaliumbromide (KBr)
Nomenclatuur van binaire zouten
Volgens de traditionele nomenclatuur worden binaire zouten benoemd door de naam van het niet-metaalhoudende element te schrijven met de uitgang -ide. Aan de andere kant wordt de naam van het metalen element geschreven op basis van zijn oxidatietoestand:
- Voor de laagste oxidatietoestand wordt deze geschreven met de uitgang -oso. Bijvoorbeeld: ijzerchloride (FeCl2), waarbij ijzer een oxidatietoestand van 2+ heeft.
- Voor de hoogste oxidatietoestand wordt het geschreven met de uitgang -ico. Bijvoorbeeld: ijzerchloride (FeCl3), waarbij ijzer een oxidatietoestand van 3+ heeft.
Volgens de systematische nomenclatuur worden binaire zouten benoemd door de naam van het niet-metaalhoudende element te schrijven met een voorvoegsel dat de hoeveelheid aangeeft. atomen van dit element in de verbinding. Bovendien wordt de uitgang -uro in de naam van het niet-metalen element geplaatst. Vervolgens wordt de naam van het metalen element geplaatst. Bijvoorbeeld: magnesiumdichloride (MgCl2) en ijzertrichloride (FeCl3).
Volgens de nomenclatuur van Stock worden binaire zouten genoemd door de naam van het niet-metaalachtige element met de uitgang -ide te schrijven. Vervolgens wordt de naam van het metalen element geplaatst, gevolgd door de oxidatietoestand ervan, geschreven in Romeinse cijfers en tussen haakjes. Bijvoorbeeld: ijzer(II)chloride (FeCl2) en kobalt(III)sulfide (Co2Ja3).
Toepassingen van binaire zouten
- Ze worden gebruikt als koelmiddel in de voedingsmiddelen- en farmaceutische industrie. Bijvoorbeeld: calciumchloride (CaCl2).
- Ze worden gebruikt om metalen oppervlakken te behandelen tegen corrosie. Bijvoorbeeld: natriumfluoride (NaF).
- Ze worden gebruikt voor het reguleren van de luchtvochtigheid in de papier- en bouwindustrie. Bijvoorbeeld: calciumchloride (CaCl2).
- Ze worden in de glasindustrie gebruikt om onzuiverheden te verwijderen. Bijvoorbeeld: siliciumtetrachloride (SiCl4).
- Ze worden gebruikt als kookingrediënt. Bijvoorbeeld: natriumchloride (NaCl).
Fysische eigenschappen van binaire zouten
- Ze hebben hoge smeltpunten omdat ze uit Ionische bindingen.
- Ze geleiden elektrische stroom wanneer ze opgelost of gesmolten zijn.
- De meest voorkomende zouten hebben een lage hardheid.
- Ze zijn niet samendrukbaar.
- De meeste kunnen in water oplossen.
Hoe worden binaire zouten verkregen?
Binaire zouten kunnen worden verkregen via enkele van de volgende chemische reacties:
Reactie tussen een metaal en een niet-metaal. Bijvoorbeeld: de reactie tussen natrium (Na) en dichloride (Cl2) produceert natriumchloride (NaCl).
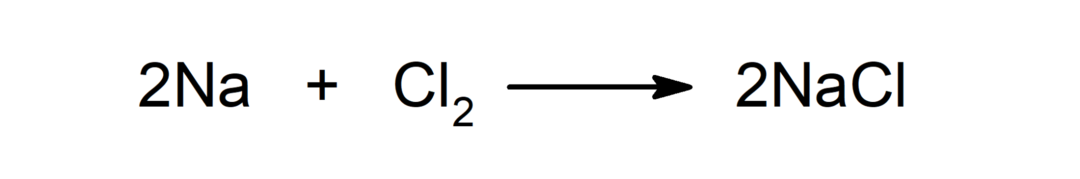
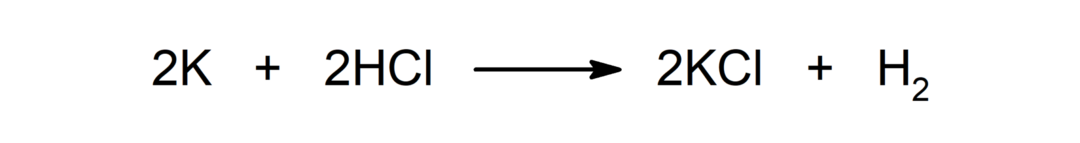
Reactie tussen een metaal en een zuur. Bijvoorbeeld: De reactie tussen kalium (K) en zoutzuur (HCl) produceert kaliumchloride (KCl) en diwaterstof (H).2).
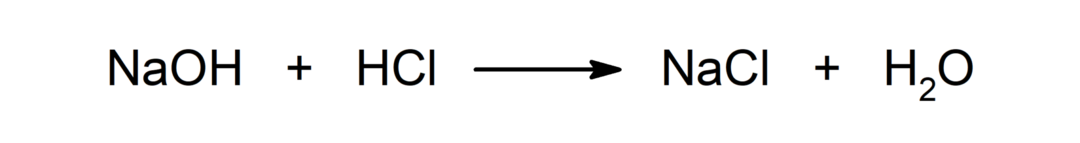
Reactie tussen een zuur en een base. Bijvoorbeeld: De reactie tussen zoutzuur (HCl) en natriumhydroxide (NaOH) produceert natriumchloride (NaCl) en water (H2OF).
Volgen met:
- oxyzouten
- neutrale zouten
- zure zouten
Referenties
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juarez, E. (2020). Nomenclatuurvideo 1: binaire zouten en chemische reactie.
- Acurio Arias, M. V., & Delgado Méndez, M. EN. (2022). Spelgebaseerde leergids voor “binaire verbindingen” in scheikunde op de middelbare school op de educatieve eenheid “Herlinda Toral”. (Bachelorscriptie, Nationale Universiteit van Onderwijs).
- Cabrera, M. J. H. (2005). Studie vanuit de eerste principes van elektronische en structurele eigenschappen van binaire en ternaire verbindingen (Doctoraal proefschrift, Universiteit van La Laguna).
